
2月25日,国家药品监督管理局附条件批准康希诺生物股份公司重组新型冠状病毒疫苗(5型腺病毒载体)注册申请。该疫苗是首家获批的国产腺病毒载体新冠病毒疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
国家药监局根据《疫苗管理法》《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准上市注册申请。国家药监局要求该疫苗上市许可持有人继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果。
 (来源:国家药品监督管理局)
(来源:国家药品监督管理局)
(来源:康希诺生物股份公司官网)
康希诺生物股份公司重组新型冠状病毒疫苗(克威莎TM)的Ⅲ期临床试验期中分析数据结果显示,单针接种疫苗28天后,疫苗对所有症状的总体保护效力为65.28%;在单针接种疫苗14天后,疫苗对所有症状总体保护效力为68.83%。疫苗对重症的保护效力分别为,单针接种疫苗28天后为90.07%;单针接种疫苗14天后为95.47%。
与此同时,强生公司(Johnson & Johnson)的单剂量COVID疫苗安全有效;可以帮助遏制新冠肺炎(COVID-19)疫情大流行。FDA的研究人员们指出,完成对该疫苗的分析后发现其有“支持良好的安全性,没有发现任何具体的安全问题,可以签发紧急使用授权(EUA)”。
(来源:FDA)
基于这一已确认的信息,FDA咨询委员会将于2月26日(周五)召开会议,决定是否推荐该疫苗在美国获得紧急使用授权(EUA)。这意味着强生公司的疫苗将成为美国批准的第三种紧急使用的疫苗;但与辉瑞(Pfizer)或莫德纳(Moderna)的两种疫苗不同,患者只需要注射一针强生疫苗;并且强生公司的疫苗也比之前授权的两种疫苗更容易运输和储存。
根据FDA科学家们的分析,强生公司的疫苗对预防新冠病毒(SARS-CoV-2)中度至重度感染病例的整体效果为66%,但在美国的有效率为72%。对于病毒变体,比如在南非,新冠病毒B.1.351变种已成为主导菌株;FDA表示,强生疫苗仍有64%的有效性。
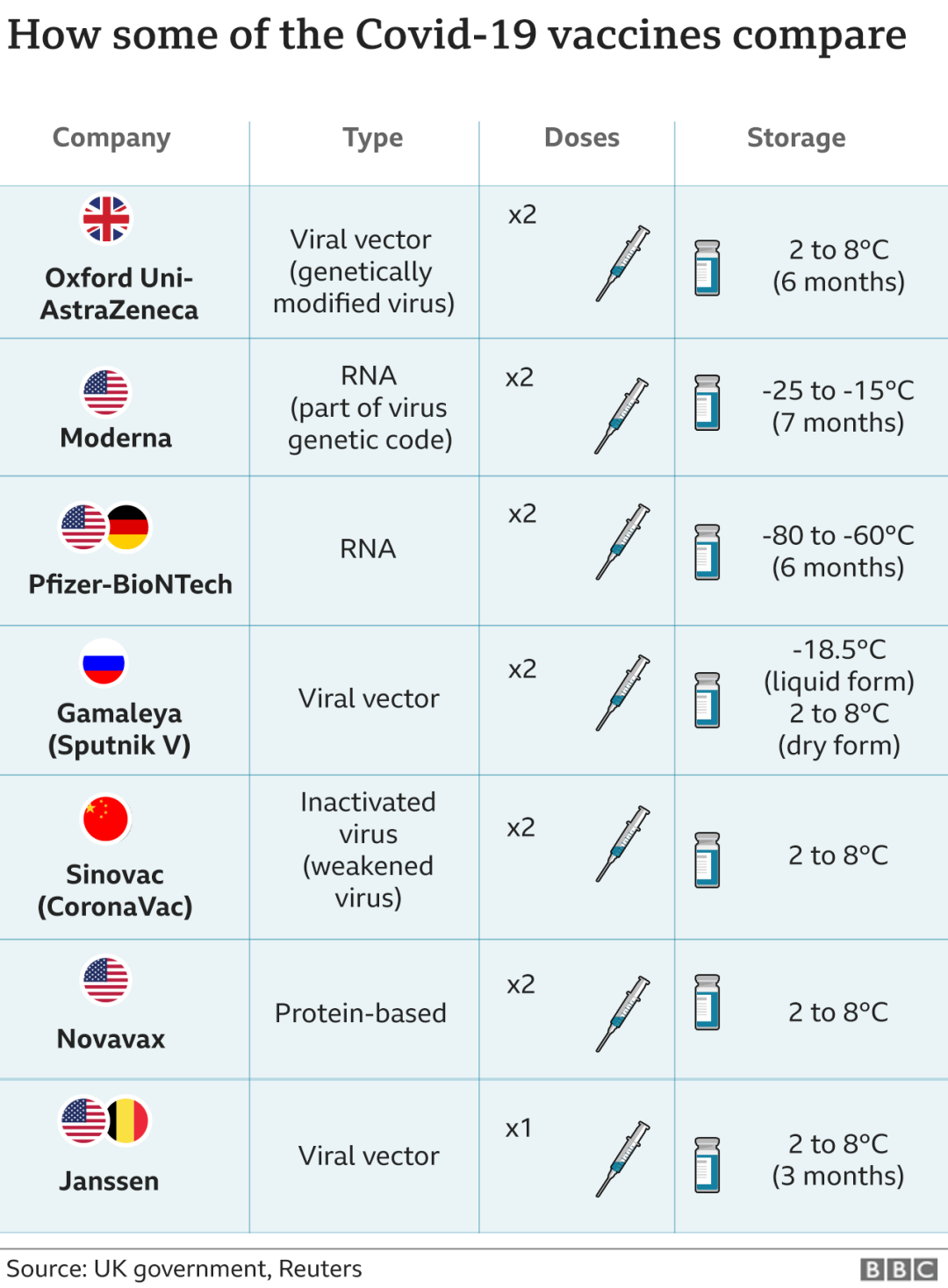
(来源:BBC)
德国维润赛润提供多种病原体系列原材料,包括天然抗原、重组抗原和人源化单抗,不同形式产品,丰富您的选择菜单。
产品咨询: VirionSerion原料事业部 18818686988 / 0755-89381139
文章内容来源于网络。
编辑:Steven | 校对:Harris | 责编:Hillson
干货分享

2021CACLP
原料展馆
N4-S069



免责声明:本文仅代表作者本人观点,不代表维润赛润资讯的观点和立场。文章图片均来源于网络,如有侵权,请联系作者删除,欢迎联系小编。



