
(一)质控品/对照品/校准品的新热点
在2021年01月18日,中国药监局发布《肺炎支原体IgM/IgG抗体检测试剂注册技术审查指导原则》中关于质控线/对照品/质控品/校准品的选择中,明确人源化抗体可用于阳性对照/质控品/校准品(见图1)。从本指导原则的发布可知,在质控品/对照品/校准品的选择上除了临床阳性样本外,新的选择给IVD人带来了新的希望!人源化抗体必将成为IVD领域炙手可热的新宠,正式开启人源化抗体在IVD新领域的应用新星之路。
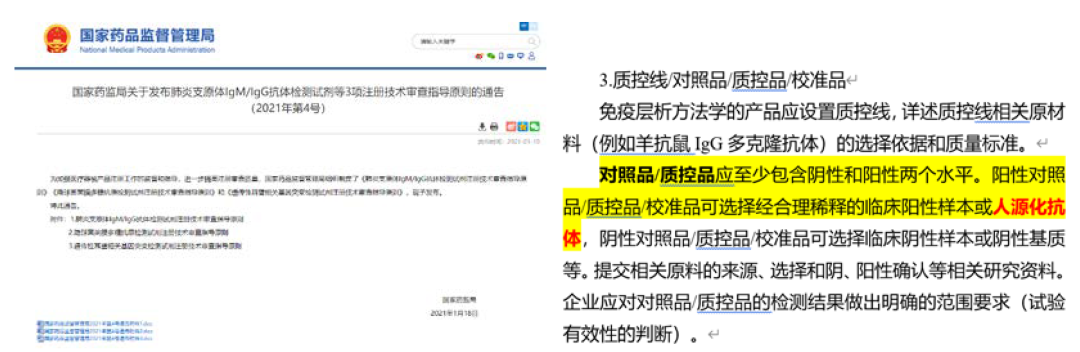
图1:《肺炎支原体IgM/IgG抗体检测试剂注册技术审查指导原则》对照品/质控品的选择
(二)国际上人源化单抗应用于质控品/对照品/校准品实证
人源化单抗技术生产于上个世界80年代中期,其原理是应用基因重组技术将小鼠抗体基因上的可变区与人抗体基因的恒定区重组后获得的抗体,具有高特异性、高稳定性,可批量生产等众多优势特点,在国际上,已有众多人源化单抗用于IVD抗体诊断试剂的质控品/对照品/校准品。
1. 国外研究
Abbott用人源化单抗制备弓形虫校准品和质控品应用于弓形虫的诊断研究中,人源化单抗与血清来源的两种校准品的检测结果高度相关,数据证明人源化单抗可替代血清来源用于弓形虫诊断的校准(见图2)。
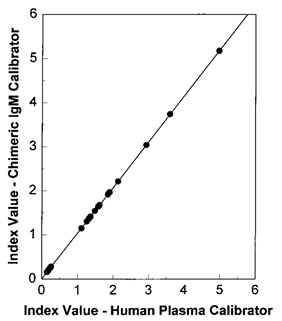
图2:人源化单抗和血清来源的阳性对照及临界值的稀释曲线对比
澳大利亚的昆士兰大学将人源化单抗用于质控品,在人源化单抗与血清来源的两种质控品的比对中,两者阳性对照和临界值的稀释曲线吻合,结果一致,证明人源化单抗可替代血清来源用于诊断试剂的阳性对照和临界值(见图3)。
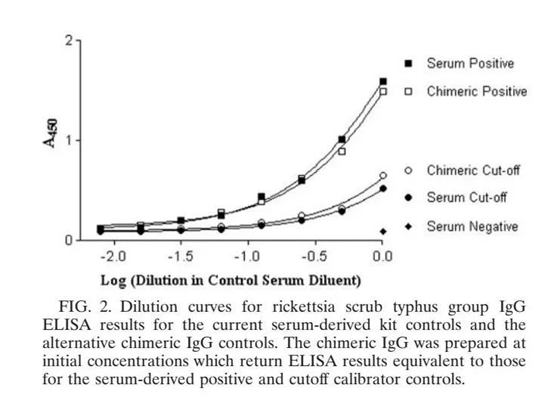
图3:人源化单抗和血清来源的阳性对照及临界值的稀释曲线对比
美国CDC将人源化单抗作为阳性对照用于检测各种黄病毒抗原的研究中,人源化单抗作为阳性对照均可与黄病毒抗原发生反应,证明人源化单抗可替代血清来源用于检测所有黄病毒感染诊断试剂的阳性对照(见图4)。

2. 国内研究
在卫生部临床检验中心将人源化单抗应用于阳性对照的研究中,人源化单抗与血清来源的阳性对照的稀释曲线之间不存在差异,结果一致;证明人源化单抗可用于替代血清来源的阳性对照(见图5)。
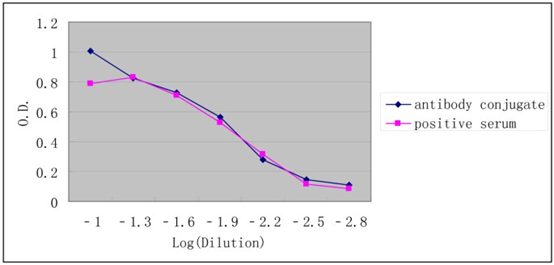
图5:人源化单抗和血清来源的阳性对照之间的稀释曲线对比
小结:
综上所述,国际上大量实用性应用表明,人源化单抗不仅可应用于IVD抗体诊断试剂的质控品/对照品/校准品,还是血清来源的完美替代品。
(三)VirionSerion人源化单抗的技术优势
1. 传统质控品的痛点
当前,质控品/阳性对照/校准品等来源于含有已知特异性抗体的血清或血浆,在生物制品的安全性监管要求越来越高、伦理监管越来越严格的趋势下,对传染病检测试剂研发生产而言,血清或血浆来源的局限性日益显现。
- 来源有限 :IgM常出现在感染早期,随后逐渐下降至消失,其存在的窗口期非常短,想获取高滴度阳性抗体更难;
- 采集量有限: 在传染病常规检测中IgM阳性率患者数量有限,即使检测到阳性患者,采集量也不大,难以形成大量采集;
- 批间差较大:不同个体之间的血液样本差异性较大,导致IgM特异性和亲和力存在批间差的问题;
- 伦理问题 :受制于合规性和伦理管制等要求;
- 安全问题 :潜在生物传染性;
- 成本过高 :由于存在上述诸多问题,使得人体血液类的IgM阳性样本来源有限,不易形成大规模的工业化批量供应,导致成本高。
2. VirionSerion人源化单抗的优势及解决方案
为了克服上述传统质控品/对照品/校准品的痛点,尤其是特异性抗体IgM的诊断试剂质控品/对照品/校准品,VirionSerion GmbH(德国维润赛润)面向全球推出了新一代人源化单抗。VirionSerion新一代人源化单抗具有以下优势:
- 高特异性;
- 高亲和力;
- 可工业化量产,不受来源限制;
- 批间差小;
- 无生物安全隐患;
- 不存在伦理管制问题。
总结
在生物安全和伦理监管的双重压力下,基于血清来源的特异性抗体质控品/阳性对照的局限性已经成为IVD生产研发领域亟待解决的一个问题。国家药监局《肺炎支原体IgM/IgG抗体检测试剂注册技术审查指导原则》对人源化抗体使用的认可,为IVD生产研发打开了一扇新的窗户。VirionSerion 推出的第二代人源化单抗具备高特异性、高亲和力、批间差小、可工业化量产、稳定供应等诸多优势,是IVD生产研发企业创新跨越的有力保障。
德国维润赛润提供多种病原体系列原材料,包括天然抗原、重组抗原和人源化单抗,不同形式产品,丰富您的选择菜单。
产品咨询:
VirionSerion原料事业部
18818686988 / 0755-89381139
编辑:Steven | 校对:Harris | 责编:Hillson
干货分享


助力我们的客户更加强大
永葆我们的价值无可替代

免责声明:本文仅代表作者本人观点,不代表维润赛润资讯的观点和立场。文章图片均来源于网络,如有侵权,请联系作者删除,欢迎联系小编。




