
-
德国维润赛润CACLP展位号:B5-0805
- III类指导原则&行业标准

-
II类指导原则&行业标准

联系小编(wx1030005726),领取EXCEL表,点击直接下载
1、指导原则
| 序号 | 指导原则 | 发布年份 |
| 1 | B组链球菌 | |
| B群链球菌核酸检测试剂注册技术审查指导原则(2021年第24号) | 2021/4/15 | |
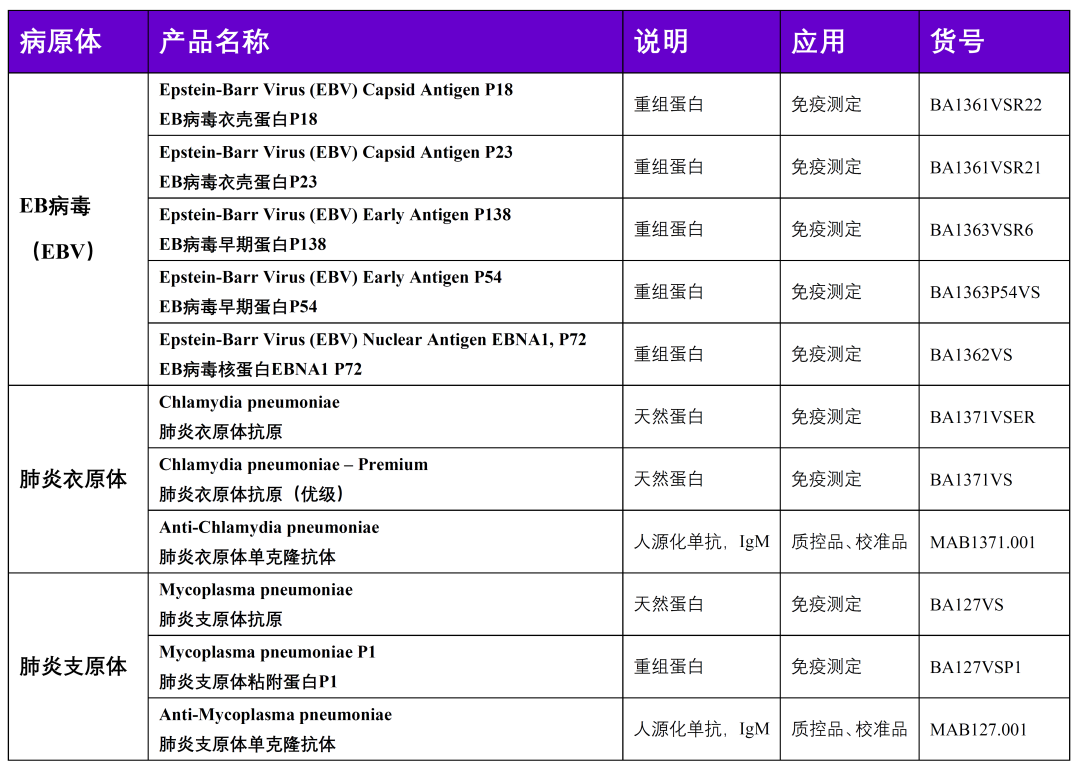
| 2 | EB病毒 | |
| EB病毒核酸检测试剂注册技术审查指导原则(2020年第16号) | 2020/3/10 | |
| 3 | 丙型肝炎病毒 | |
| 丙型肝炎病毒核酸基因分型检测试剂盒注册技术审查指导原则(2017年第209号) | 2017/12/22 | |
| 丙型肝炎病毒核糖核酸测定试剂技术审查指导原则(2015年第93号) | 2015/4/5 | |
| 4 | 病原体IgM | |
| 病原体特异性M型免疫球蛋白定性检测试剂注册技术审查指导原则(2013年第3号) | 2013/3/29 | |
| 5 | 肠道病毒 | |
| 肠道病毒核酸检测试剂注册技术审查指导原则(2018年第36号) | 2018/2/24 | |
| 6 | 登革病毒 | |
| 登革病毒核酸检测试剂注册技术审查指导原则(2020年第32号) | 2020/5/14 | |
| 7 | 肺炎支原体 | |
| 肺炎支原体IgM/IgG抗体检测试剂注册技术审查指导原则(2021年第4号) | 2021/1/19 | |
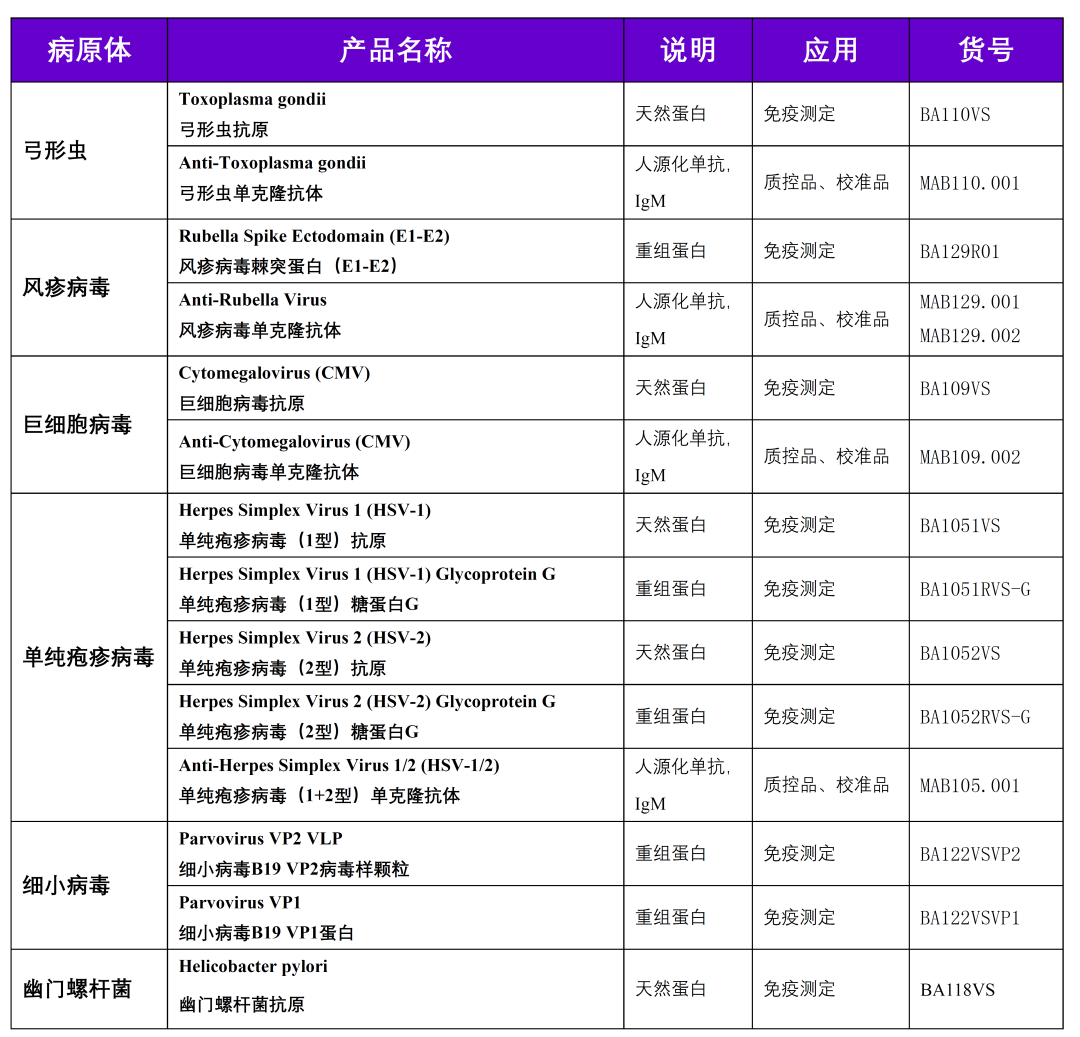
| 8 | 弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒 | |
| 弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒抗体及G型免疫球蛋白抗体亲合力检测试剂技术审查指导原则(2014年第2号) | 2014/3/29 | |
| 9 | 呼吸道病毒多重核酸检测 | |
| 呼吸道病毒多重核酸检测试剂注册技术审查指导原则(2019年第80号) | 2019/11/15 | |
| 10 | 金黄色葡萄球菌 | |
| 基于核酸检测方法的金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌检测试剂注册技术审查指导原则(2019年第80号) | 2019/11/15 | |
| 11 | 结核分枝杆菌 | |
| 结核分枝杆菌复合群核酸检测试剂注册技术审查指导原则(2015年第65号) | 2015/4/5 | |
| 结核分枝杆菌复合群耐药基因突变检测试剂注册技术审查指导原则(2017年第25号) | 2017/3/28 | |
| 结核分枝杆菌特异性细胞免疫反应检测试剂注册技术审查指导原则(2018年第57号) | 2018/3/21 | |
| 12 | 流行性感冒 | |
| 流行性感冒病毒核酸检测试剂注册申报资料指导原则(2011年第540号) | 2011/12/23 | |
| 流行性感冒病毒抗原检测试剂注册申报资料指导原则(2011年第540号) | 2011/12/23 | |
| 13 | 轮状病毒 | |
| 轮状病毒抗原检测试剂注册技术审查指导原则(2021年第24号) | 2021/4/15 | |
| 14 | HIV | |
| 人类免疫缺陷病毒检测试剂临床研究注册技术审查指导原则(2013年第3号) | 2013/3/29 | |
| 15 | HPV | |
| 人乳头瘤病毒(HPV)核酸检测及基因分型试剂注册技术审查指导原则(2015年第93号) | 2015/4/5 | |
| 16 | 细小病毒B19 | |
| 人细小病毒B19 IgM/IgG抗体检测试剂注册技术审查指导原则(2021年第24号) | 2021/4/15 | |
| 17 | 沙眼衣原体和/或淋病奈瑟菌 | |
| 沙眼衣原体和/或淋病奈瑟菌核酸检测试剂注册技术审查指导原则(2019年第80号) | 2019/11/15 | |
| 18 | 新冠 | |
| 新型冠状病毒(2019-nCoV)核酸检测试剂注册审查指导原则(2022年第18号).docx | 2022/4/27 | |
| 新型冠状病毒(2019-nCoV)抗体检测试剂注册审查指导原则(2022年第18号).docx | 2022/4/27 | |
| 新型冠状病毒(2019-nCoV)抗原检测试剂注册审查指导原则(2022年第18号).docx | 2022/4/27 | |
| 19 | 乙型肝炎病毒 | |
| 乙型肝炎病毒e抗原、e抗体检测试剂注册技术审查指导原则(2020年第16号) | 2020/3/10 | |
| 乙型肝炎病毒基因分型检测试剂技术审查指导原则(2015年第32号) | 2015/4/1 | |
| 乙型肝炎病毒脱氧核糖核酸定量检测试剂注册技术审查指导原则(2013年第3号) | 2013/3/29 | |
| 20 | 隐球菌 | |
| 隐球菌荚膜多糖抗原检测试剂注册技术审查指导原则(2021年第4号) | 2021/1/19 | |
| 21 | 幽门螺杆菌 | |
| 幽门螺杆菌抗原/抗体检测试剂注册技术审查指导原则(2018年第36号) | 2018/2/24 | |
2、行业标准
| 序号 | 行业标准 | 发布年份 |
| 1 | 新冠 | |
| GB/T 40966-2021新型冠状病毒抗原检测试剂盒质量评价要求 | 2021 | |
| GB/T 40982-2021新型冠状病毒核酸检测试剂盒质量评价要求 | 2021 | |
| GB/T 40983-2021新型冠状病毒 IgG抗体检测试剂盒质量评价要求 | 2021 | |
| GB/T 40984-2021新型冠状病毒 IgM抗体检测试剂盒质量评价要求 | 2021 | |
| GB/T 40999-2021新型冠状病毒抗体检测试剂盒质量评价要求 | 2021 | |
| 2 | HIV | |
| YY/T 1514-2017 人类免疫缺陷病毒(1+2型)抗体检测试剂(盒)(免疫印迹法) | 2017 | |
| YY/T 1515-2017 人类免疫缺陷病毒(Ⅰ型)核酸定量检测试剂(盒) | 2017 | |
| YY/T 1526-2017 人类免疫缺陷病毒抗原抗体联合检测试剂盒(发光类) | 2017 | |
| YY/T 1611-2018 人类免疫缺陷病毒抗体检测试剂盒(免疫层析法) | 2018 | |
| YY 1727-2020 口腔黏膜渗出液人类免疫缺陷病毒抗体检测试剂盒(胶体金免疫层析法) | 2020 | |
| 3 | HPV | |
| YY/T 1226-2014 人乳头瘤病毒核酸(分型)检测试剂(盒) | 2014 | |
| 4 | 弓形虫 | |
| YY/T 1237-2014 弓形虫IgG抗体检测试剂(盒)(酶联免疫法) | 2014 | |
| 5 | 风疹病毒 | |
| YY/T 1235-2014 风疹病毒IgG/IgM抗体检测试剂(盒) | 2014 | |
| 6 | 巨细胞病毒 | |
| YY/T 1236-2014 巨细胞病毒IgG/IgM抗体检测试剂(盒) | 2014 | |
| 7 | 单纯疱疹病毒 | |
| YY/T 1482-2016 单纯疱疹病毒IgG抗体检测试剂(盒) | 2016 | |
| YY/T 1483-2016 单纯疱疹病毒IgM抗体检测试剂(盒) | 2016 | |
| 8 | 细小病毒B19 | |
| YY/T 1645-2019 人细小病毒B19 IgG抗体检测试剂盒 | 2019 | |
| 9 | 肺炎衣原体 | |
| YY/T 1667-2020 肺炎衣原体IgG抗体检测试剂盒(酶联免疫吸附法) | 2020 | |
| 10 | 肺炎支原体 | |
| YY/T 1225-2014 肺炎支原体抗体检测试剂盒 | 2014 | |
| 11 | EB病毒 | |
| YY/T 1517-2017 EB病毒衣壳抗原(VCA)IgA抗体检测试剂盒 | 2017 | |
| 12 | 细菌和真菌多重感染 | |
| YY/T 1725-2020 细菌和真菌感染多重核酸检测试剂盒 | 2020 | |
| 13 | 酵母样真菌 | |
| YY/T 1728-2021 临床实验室检测和体外诊断系统 感染性疾病相关酵母样真菌抗菌剂的体外活性检测参考方法 | 2021 | |
| 14 | 丙型肝炎病毒 | |
| YY/T 1215-2013 丙型肝炎病毒(HCV)抗体检测试剂盒(胶体金法) | 2013 | |
| YY/T 1735-2021 丙型肝炎病毒抗体检测试剂(盒)(化学发光免疫分析法) | 2021 | |
| 15 | 乙型肝炎病毒 | |
| YY/T 1247-2014 乙型肝炎病毒表面抗原测定试剂(盒)(化学发光免疫分析法) | 2014 | |
| YY/T 1248-2014 乙型肝炎病毒表面抗体测定试剂(盒)(化学发光免疫分析法) | 2014 | |
| 16 | 戊型肝炎病毒 | |
| YY/T 1259-2015 戊型肝炎病毒IgG抗体检测试剂盒(酶联免疫吸附法) | 2015 | |
| YY/T 1260-2015 戊型肝炎病毒IgM抗体检测试剂盒(酶联免疫吸附法) | 2015 | |
| 17 | 甲型流感病毒 | |
| YY/T 1443-2016 甲型流感病毒抗原检测试剂盒(免疫层析法) | 2016 | |
| YY/T 1462-2016 甲型H1N1流感病毒RNA检测试剂盒(荧光PCR法) | 2016 | |
| YY/T 1596-2017 甲型流感病毒核酸检测试剂盒(荧光PCR法) | 2017 | |
| 18 | 解脲脲原体 | |
| YY/T 1256-2015 解脲脲原体核酸扩增检测试剂盒 | 2015 | |
| 19 | 沙眼衣原体 | |
| YY/T 1424-2016 沙眼衣原体DNA检测试剂盒(荧光PCR法) | 2016 | |
| 20 | 幽门螺杆菌 | |
| YY/T 1423-2016 幽门螺杆菌抗体检测试剂盒(胶体金法) | 2016 | |

公司简介

助力我们的客户更加强大
永葆我们的价值无可替代





