
中华医学会儿科学分会呼吸学组疑难少见病协作组
国家呼吸系统疾病临床医学研究中心
首都医科大学附属北京儿童医院
通信作者:徐保平,Email:xubaopingbch@163.com;申昆玲,Email:kunlingshen1717@163.com
本文刊发于 中华实用儿科临床杂志,2022,37(22):1688-1693.
引用本文:中华医学会儿科学分会呼吸学组,中华医学会儿科学分会呼吸学组疑难少见病协作组,国家呼吸系统疾病临床医学研究中心,等.儿童变应性支气管肺曲霉病诊治专家共识[J].中华实用儿科临床杂志,2022,37(22):1688-1693.DOI:10.3760/cma.j.cn101070-20220508-00521.
共识制定专家组由来自儿科、呼吸、影像学多学科专家组成。在本共识的制定过程中,首先由撰写小组成员通过文献回顾初步提出临床问题,经共识制定专家对临床问题进行筛选,最终确定10个问题。本共识的目标人群为18岁以下儿童,使用人群为儿科临床医师、呼吸科医师及护理人员。
ABPA是一种变应性肺疾病,是由于机体对曲霉,主要由烟曲霉(Aspergillus fumigatus)的变态反应所致。目前其发病机制尚不完全清楚。
烟曲霉广泛存在于环境中,在正常情况下,人体可以将吸入气道的曲霉孢子清除;而在一些有遗传易感性的患儿中,由于其黏液纤毛清除功能障碍、气道上皮细胞功能异常或者局部免疫异常,不能清除吸入的曲霉孢子,引起其在气道内定植,并在局部萌芽分生出菌丝。曲霉菌丝并不产生侵袭性感染,但孢子和菌丝的抗原成分及产生的蛋白酶会诱发机体的变态反应。固有免疫细胞(气道上皮细胞、树突状细胞、巨噬细胞等)识别、提呈烟曲霉抗原,激活Th2细胞,活化的Th2细胞分泌细胞因子,包括白细胞介素(IL)-4、IL-5、IL-13等,激活嗜酸性粒细胞,引起免疫球蛋白E(IgE)合成增加[包括总IgE(TIgE)和烟曲霉特异性IgE(sIgE)]以及肥大细胞脱颗粒,进一步介导气道内黏液分泌的增加、嗜酸性粒细胞及中性粒细胞的聚集[3]。上述免疫反应引起ABPA特征性病理表现,即嗜酸性粒细胞肺炎、支气管中心性肉芽肿、黏液堵塞和支气管扩张[4]。
ABPA较常发生于哮喘及囊性纤维化(cystic fibrosis,CF)患儿中,也可见于结核病、原发性纤毛运动障碍及免疫缺陷病,如慢性肉芽肿病、高IgE综合征等引起的支气管扩张症患儿中[5-8]。
哮喘患儿由于气道存在慢性炎症,导致其气道上皮功能异常及黏液高分泌,吸入气道的烟曲霉孢子清除异常。ABPA在哮喘中的总体患病率为2.5%[9],在激素依赖性哮喘患者中发生率为7%~14%,而在重症需要住院的哮喘患者中发生率可高达39%[10]。印度的一项研究显示,ABPA在哮喘控制不佳儿童中的发生率达26%[11]。CF是由CFTR基因变异引起的常染色体隐性遗传病,由于氯离子通道异常,患儿气道表面液体明显减少,影响黏液纤毛清除功能及病原体的清除,从而导致烟曲霉的局部定植。CF中ABPA的总体发生率为10%~25%[12]。
ABPA的临床特征为反复发作的咳嗽、咯痰、喘息,可伴有发热、胸闷、乏力、体重减轻等非特异性的临床表现。咯棕褐色黏液胶冻样痰是ABPA相对特异的临床表现,约50%的患者可以出现。但由于儿童患者咯痰能力弱或不会咯痰,这一症状出现比率较低[13]。发生支气管扩张的患儿可有不同程度的咯血。体格检查时肺部可闻及湿啰音或哮鸣音。晚期患儿可出现杵状指/趾和发绀。肺不张时表现为呼吸音减低。
对于哮喘儿童,在规律抗哮喘治疗情况下,如果出现喘息症状控制不佳,伴有咯痰、气短、发热、体重减轻时需要考虑合并ABPA的可能性[13]。CF患儿出现临床症状恶化,如咳嗽、痰量增加或痰液颜色变化、喘息、呼吸困难、新出现的发热、体重减轻、对常规治疗反应不佳而不能用其他原因解释等情况时,也需要考虑 ABPA。有文献提出,ABPA症状与CF本身临床表现相似,因此对于CF患者需要在常规随访时检查有无合并ABPA[14]。
(1)外周血嗜酸性粒细胞计数 外周血嗜酸性粒细胞计数>0.5×109/L是ABPA的诊断依据之一。但因约有1/4的ABPA患者外周血嗜酸性粒细胞计数<0.5×109/L,因此外周血嗜酸性粒细胞计数正常也不能排除ABPA[15]。外周血嗜酸性粒细胞计数易受到应用全身糖皮质激素的影响,故作为诊断依据时需要注意应为未经过糖皮质激素治疗时的外周血嗜酸粒细胞计数。
(2)血清TIgE 血清TIgE水平是ABPA诊断及治疗随访过程中最有价值的实验室检查。在未经全身糖皮质激素治疗情况下,TIgE>1 000 IU/mL是诊断ABPA的标准之一。对于临床怀疑ABPA且TIgE在500~1 000 IU/mL的患儿需要定期复查。CF患儿TIgE>500 IU/mL 时建议进行ABPA的其他诊断性检查;200~500 IU/mL时应间隔1~3个月复查[16]。TIgE正常时基本可除外ABPA。
(3)烟曲霉皮肤试验 烟曲霉皮肤试验是检测有无烟曲霉过敏的重要检查,烟曲霉皮肤试验阳性是ABPA诊断标准之一。皮肤试验包括点刺试验和皮内试验,两者阳性均可以作为ABPA的诊断依据。皮肤试验阳性的判定标准均为风团直径>3 mm。
烟曲霉皮肤试验对ABPA的诊断敏感性很高,但特异性较差。烟曲霉皮肤试验阳性也可见于对烟曲霉过敏的哮喘或CF患儿。皮肤点刺试验和皮内试验阳性虽均可以作为ABPA的诊断依据,但两者的敏感性不同,皮内试验较点刺试验的敏感性高[17]。一般点刺试验作为筛查检查,如果结果阴性,但临床高度怀疑ABPA时可进一步进行皮内试验。
(4)烟曲霉sIgE 烟曲霉slgE主要用于ABPA的常规筛查和诊断。目前多以0.35 kUA/L作为ABPA的诊断界值,其对ABPA诊断的敏感性高于烟曲霉皮肤试验,可达97%~100%[18]。但烟曲霉sIgE不是ABPA的特异性指标,对ABPA诊断的特异性约为67%~70%[19]。
烟曲霉sIgE阳性也可见于烟曲霉过敏性的哮喘或烟曲霉变应性鼻窦炎等患儿中。虽然烟曲霉sIgE升高有助于ABPA的诊断,但其对患儿的随访没有帮助。在一项研究中发现,52%的患者在治疗后烟曲霉sIgE不降低反而升高,而在ABPA病情恶化时仅有39%的患者烟曲霉sIgE升高[20];故不将其作为ABPA治疗过程中的监测指标。
(5)烟曲霉特异性IgG(specific-IgG,sIgG)和血清沉淀抗体 烟曲霉sIgG也是ABPA相对特异的实验室检查,诊断界值为26.9 mgA/L时其对ABPA诊断的敏感性和特异性分别为88%和100%[21]。而烟曲霉血清沉淀抗体阳性提示既往有烟曲霉暴露,测定水平明显升高时提示有ABPA的可能性[22],但其对于ABPA的诊断特异性及敏感性均低于烟曲霉sIgG,目前不作为ABPA的诊断标准。
(6)痰液检查 黏液痰栓病理检查可发现嗜酸性粒细胞、夏科雷登结晶和纤维蛋白渗出物以及丝状真菌[3]。痰或者支气管肺泡灌洗液培养烟曲霉阳性不是ABPA的诊断指标,但考虑到耐药问题,建议对需要使用抗曲霉药物治疗的患儿,在治疗前进行痰或支气管肺泡灌洗液培养,以根据药敏试验结果调整用药。
(7)肺功能 肺功能不作为ABPA的诊断依据,但是ABPA治疗随访过程中重要的监测指标。ABPA早期肺功能多表现为部分可逆的阻塞性通气功能障碍。ABPA病情进展肺部出现间质性改变时表现为持续性阻塞性通气功能障碍和肺总量、肺活量及第1秒用力呼气容积(forced expiratory volume,FEV1)下降[23]。急性期和复发期可表现为弥散功能减低,而在缓解期弥散功能改善[24]。
容积重建薄层CT或高分辨率断层计算机扫描(high-resolution computerized tomography,HRCT)是诊断ABPA的首选影像学检查方法。中心型支气管扩张和一过性的肺部浸润影是ABPA最常见的影像学改变,高密度黏液嵌塞是ABPA相对特异性的影像学表现,其密度往往高于肌肉密度,甚至类似钙化表现。中心型支气管扩张伴高密度黏液栓时胸片或HRCT上呈现“指套征”或“牙膏征”,可伴或不伴肺实变/肺不张。少数病变后期可出现肺空洞和/或肺纤维化征象。HRCT还可见小叶中心性结节伴树芽征、呼气相马赛克征[25]。
有研究根据ABPA的影像学表现将其分为4型[26]:(1)血清型(serologic ABPA,ABPA-S):满足临床、实验室及血清学诊断标准,但无肺部影像学异常;(2)支气管扩张型(ABPA- bronchiectasis,ABPA-B):符合ABPA诊断标准,影像学有中心型支气管扩张;(3)高密度黏液栓型(ABPA-high attenuation mucus,ABPA-HAM):符合ABPA诊断标准,影像学有高密度黏液栓;(4)慢性胸膜肺纤维化型(ABPA-chronic pleuropulmonary fibrosis,ABPA-CPF):符合ABPA诊断标准,影像学除存在中心型支气管扩张外,还有其他改变,如肺纤维化、瘢痕形成、肺气肿、纤维空洞和胸膜改变。ABPA-S属于ABPA的早期改变;ABPA-B和ABPA-HAM则可能提示ABPA的严重性及反复加重;ABPA-CPF则是疾病的晚期改变。
ABPA诊断标准自1977年提出以来经过几版修订[26-28]。结合我国的临床实践特点和临床使用的方便性,推荐国际人类和动物真菌协会(International Society for Human and Animal Mycology,ISHAM)修订版诊断标准[29]作为我国儿童ABPA的诊断标准,即有基础疾病患儿满足2条必备条件和其他条件中至少2条可诊断ABPA(表1)。

根据ABPA的临床症状及治疗反应分为5期[27],即急性期、缓解期、复发期、糖皮质激素依赖期和肺纤维化期(表2)。

2013年ISHAM对哮喘合并ABPA进行了新的分期[26],将其分为7期。虽然分期更为细致,但过于复杂,不便于临床使用,本专家共识仍推荐5期分类。
ABPA的治疗目标是最大限度地减轻炎症反应,减少气道真菌定植,控制症状,减少恶化,维持和/或恢复肺功能[29]。ABPA治疗药物主要包括糖皮质激素和抗真菌药物。
(1)糖皮质激素 口服糖皮质激素是ABPA的主要治疗药物,其可以控制症状,减少疾病复发。对于哮喘合并ABPA急性期(Ⅰ 期)及复发期(Ⅲ 期)患儿初始治疗推荐低剂量方案[30],即起始剂量泼尼松龙0.5 mg/(kg·d),每日口服,2周后减为0.5 mg/(kg·d),隔日口服,共8周;此后每2周减量2.5~5.0 mg,于3~5个月内减停,但治疗时间可依据病情严重程度有所调整。对于糖皮质激素依赖期(Ⅳ期)患儿可能需要长期口服小剂量糖皮质激素维持治疗。对CF合并ABPA Ⅰ 期和 Ⅲ 期患儿推荐糖皮质激素治疗方案如下:泼尼松初始剂量为0.5~2.0 mg/(kg·d)(最大量60 mg/d),1~2周后改为隔日0.5~2.0 mg/kg,于2~3个月内逐渐减停[31]。长期或反复使用糖皮质激素的患儿应监测其不良反应,包括库欣综合征、高血压、眼压升高、体重增加和骨质疏松症。不推荐ABPA患儿使用吸入性糖皮质激素。
对于哮喘合并ABPA急性期患儿,有随机对照试验比较较高剂量和较长疗程糖皮质激素方案,即起始剂量0.75 mg/(kg·d),6周,减量为0.50 mg/(kg·d),6周,此后每6周减量5 mg,总疗程6~12个月,与上述低剂量糖皮质激素治疗方案相比,低剂量糖皮质激素治疗方案在预防ABPA病情恶化和糖皮质激素依赖方面同样有效,且不良反应更少[30]。
有研究评估吸入高剂量糖皮质激素在 ABPA-S 中的作用,结果显示单独使用高剂量吸入性糖皮质激素治疗ABPA-S无效,不推荐其作为ABPA的糖皮质激素治疗方案,仅用于哮喘合并ABPA时哮喘控制用药[32]。
(2)抗真菌治疗 对于ABPA是否使用抗真菌治疗目前尚无一致结论,但由于抗真菌治疗可通过减少真菌定植从而减轻气道炎症反应而发挥治疗作用[33],对于急性期、复发期及糖皮质激素依赖期ABPA患儿,无论痰或支气管肺泡灌洗液培养烟曲霉菌阳性与否,均推荐糖皮质激素联合抗真菌治疗,以减少ABPA患儿糖皮质激素依赖的产生及减少全身糖皮质激素的用量。使用抗真菌药物期间需要定期监测肝肾功能,有条件时进行药物浓度监测。不推荐抗真菌药物雾化治疗。
多个随机对照试验研究显示,在急性期ABPA单药治疗中,泼尼松龙较伊曲康唑能更有效地诱导ABPA患者进入临床缓解期,但两组的TIgE下降百分比、肺功能改善情况及在1年和2年治疗后恶化的受试者数量及首次发作时间相似[34];伏立康唑与泼尼松龙单药治疗相比临床疗效相当[35];泼尼松龙单药与泼尼松龙联合伊曲康唑治疗相比,治疗1年内ABPA恶化的比例、血清TIgE下降、肺功能FEV1改善两组间差异无统计学意义,未出现糖皮质激素依赖[36]。在糖皮质激素依赖ABPA患者中,伊曲康唑与安慰剂相比可以减少激素使用剂量并降低TIgE水平[37]。对临床稳定ABPA患者的研究表明,使用伊曲康唑后,痰液炎性标志物、血清TIgE水平和病情加重的频率均降低[38]。
抗真菌药物推荐伊曲康唑、伏立康唑。伊曲康唑的推荐剂量为5 mg/(kg·d),1次或分2次口服,最大量400 mg/d,疗程3~6个月;伏立康唑的参考剂量见表3,疗程4~6个月[31]。泊沙康唑用于儿童CF合并ABPA患者,基于目前有限的文献报道,口服泊沙康唑可参考剂量如下:体重>35 kg:混悬液400 mg/次,每日2次,片剂负荷量300 mg/次,每日2次口服1 d,维持量300 mg/次,每日1次;体重>25 kg且<35 kg:混悬液300 mg/次,每日2次;体重<25 kg:混悬液18~24 mg/(kg·d)[31,39]。对于有真菌培养结果的患儿,也可以根据真菌药敏试验结果选择抗真菌药物。
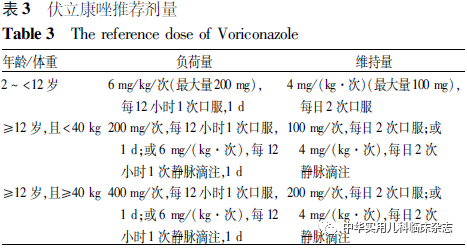
伊曲康唑与糖皮质激素联合使用时可抑制糖皮质激素的代谢,提高糖皮质激素的浓度,增强糖皮质激素作用,但不需要额外调整糖皮质激素剂量,其剂量调整按照上述治疗方案进行。
对于雾化脂质体两性霉素B作为ABPA维持治疗方案的随机、多中心试验显示,其不能降低ABPA严重临床恶化的风险[40]。
(3)单克隆抗体 目前一些单克隆抗体也用于ABPA的治疗,包括奥马珠单抗、美泊利单抗、度匹鲁单抗和贝那利珠单抗。这些药物在ABPA中的应用尚需大样本随机对照试验以确定其有效性和安全性。
奥马珠单抗是一种人源化抗IgE单克隆抗体。一篇关于奥马珠单抗治疗ABPA的已发表文献的综述,共纳入30篇文献,其中28篇为个例报告。在28篇文献中奥马珠单抗用于ABAP治疗失败患者,其剂量范围225~750 mg,给药频率从每周1次到每月1次不等,最常用的剂量为每2周375 mg,疗程3个月~6年。结果显示,奥马珠单抗具有可接受的安全性和良好的耐受性。奥马珠单抗治疗后,患者的症状、恶化率、糖皮质激素使用减少,呼出气一氧化氮和血清TIgE降低,但肺功能无明显改善。提示奥马珠单抗可能是ABPA患者治疗失败时的替代疗法,但需要随机双盲安慰剂对照试验以确定其对ABPA治疗的有效性和安全性。
美泊利单抗是一种抗IL-5单克隆抗体。一项纳入20例 ABPA患者的观察性研究显示,美泊利单抗(100 mg/次,每4周1次)治疗6个月后ABPA患者的血嗜酸性粒细胞和FEV1显著下降,哮喘控制水平改善,同时还减少了口服糖皮质激素用量及ABPA恶化的次数[41];但同奥马珠单抗一样,目前的研究仍较少,尚需要大样本随机对照试验以确定其有效性和安全性。
IL-4α受体拮抗剂度匹鲁单抗[42]、IL-5α受体拮抗剂贝那利珠单抗[43]等也被用于治疗ABPA,但目前的临床证据主要来自病例报告,尚需要进一步的临床试验证实。
TIgE水平是判断ABPA治疗效果和监测病情变化的重要指标。如果急性期患儿经过治疗临床症状缓解,TIgE水平下降>35%且维持6个月以上可判定为ABPA 缓解。
一般急性期和复发期患儿需要每6~8周监测TIgE,缓解期每6个月~1年复查1次。外周血嗜酸性粒细胞计数也是ABPA临床缓解的一项指标,应同TIgE一样定期监测。胸X线片或HRCT急性期每4~8周检查1次,以后根据病情需要进行复查。肺功能建议每年至少复查1次。
在ABPA患儿的病情监测过程中,需确定每个患儿的个人TIgE基线值。若TIgE较基线水平升高2倍以上,即使没有出现临床症状及肺部浸润影等改变,也提示疾病复发。
ABPA的预后与影像学分型、诊断治疗时间、并发症及基础疾病有关。ABPA-S整体预后较好,但ABPA-B预后往往不佳,容易出现咯血、反复感染、肺功能恶化等[44]。如支气管扩张合并高密度黏液栓复发率更高,肺功能和预后更差[45]。诊断时间及治疗时机与ABPA的预后密切相关。如能在不可逆性肺损害发生之前诊断并开始治疗,ABPA的整体预后较好。CF患者合并ABAP复发率高于哮喘患者。
目前儿童ABPA存在较高的漏诊及误诊情况,对于儿童ABPA的诊治缺乏统一规范的指南。希望通过本专家共识使儿科临床医务工作者能更好地认识ABPA,提高ABPA的早期诊断,并给予相对规范的治疗,以改善患儿的整体预后。
参与本共识讨论和审阅的专家(按单位汉语拼音排序):安徽医科大学第一附属医院(丁俊丽);重庆医科大学附属儿童医院(符州);国家儿童医学中心,国家呼吸系统疾病临床医学研究中心,首都医科大学附属北京儿童医院(陈兰勤、刘秀云、彭芸、申昆玲、王昊、徐保平、殷菊、曾津津);广西医科大学第一附属医院(农光民);广州市妇女儿童医疗中心(卢根);贵州医科大学附属医院(朱晓萍);哈尔滨医科大学附属第二医院(曲书强);首都儿科研究所附属儿童医院(曹玲、朱春梅);首都医科大学附属北京世纪坛医院(王仁贵);山东第一医科大学附属省立医院(陈星、刘奉琴);深圳市儿童医院(郑跃杰、申昆玲);四川大学华西第二医院(刘瀚旻);苏州大学附属儿童医院(严永东);厦门大学附属第一医院(杨运刚);中国医科大学附属盛京医院(蔡栩栩、尚云晓);中华实用儿科临床杂志(李建华)
参考文献略
(制作:新乡医学院期刊社网络与数字出版部)

公司简介

助力我们的客户更加强大
永葆我们的价值无可替代






