
病原体初次侵入人体后,机体内体液免疫应答首先产生IgM抗体,因此,临床对IgM抗体阳性特别重视,视为急性期感染指标,甚至因单独IgM抗体阳性而采取治疗或其他临床措施。实际上,IgM只是筛查指标,其阳性结果提示但不等同于确认急性感染。IgM抗体”假阳性”并不少见,需要结合免疫学检测方法特点、病原体感染后的机体免疫反应规律、临床表现等进行综合评估,否则可能会导致不当临床处置或过度医疗。
当机体出现急性感染时,无论是初次感染还是复发感染、再感染,体内产生抗体是一个急剧变化的过程,因此,定量分析是TORCH筛查的最佳选择,不仅可用于评估个体免疫状态,还可基于动态的定量结果判别感染活动期。临床常用两种方法进行血清IgM抗体的定量或半定量检测:捕获法和间接法。
有酶标抗原捕获法和中和抗原捕获法。酶标抗原捕获法是将抗人IgM抗体(如羊抗人或鼠抗人IgMμ链抗体)包被在固相载体上形成固相抗体(二抗),当加入血清标本时,其中的IgM类抗体(特异的或非特异的)即可被固相抗体捕获,加入酶标记的特异性抗原后,可形成”固相二抗-血清IgM抗体-酶标特异性抗原复合物”,再加入底物反应后,可对标本中的IgM进行半定量、定量的检测。
中和抗原捕获法与酶标抗原捕获法基本过程相似,不同的是酶标记在特异性抗体上,形成的是”固相二抗-血清IgM抗体-特异性中和抗原-酶标记特异性抗体复合物”。
该方法是将特异性抗原包被在固相载体上形成固相抗原,加入待测标本后,标本中的IgM类抗体(特异的或非特异的)均会被固相抗原捕获,随后加入酶标记抗人IgM抗体,形成”固相抗原-血清IgM抗体-酶标记抗人IgM抗体复合物”,在加入底物反应后,可对待测标本中的IgM进行半定量、定量的检测。
方法学评估:间接法较捕获法更容易受到非特异性干扰,因此在血清检测前一般会预先吸附特异性IgG抗体、类风湿因子(rheumatoid factor,RF)。
IgM阳性一般提示急性期感染,当实验室IgM阳性结果与感染状态不符时,临床视之为”假阳性”,常见原因主要有两方面:检测技术的局限性、被检测个体的免疫特性。
涉及IgM抗体的特殊性、IgM抗体阳性的参考范围设定和TORCH-IgM抗体检测标准。
IgM抗体的特殊性:IgM抗体是五聚体(有10个抗原结合表位),其结构特点导致IgM易于与抗原(特异性或非特异性)结合、存在交叉反应,可出现假阳性检测结果。RF、天然血型抗体、冷凝集素、自身免疫性抗体等都可能是干扰因素。以RF为例,这是一种抗人或动物IgG分子Fc片段抗原决定簇的抗体,其介导作用可导致IgM检测结果的假阳性。
IgM抗体阳性的参考范围设定:IgM抗体参考范围是根据已知的阴、阳性标本确定,在确定阳性切割值(cut-off)时需要兼顾筛查的敏感度和特异度,有大约3%~5%的假阳性问题。
TORCH-IgM抗体检测尚无金标准:不同检测试剂所用的关键活性材料不同,不同试剂盒的检测原理不同,同一标本用不同平台检测可能会出现不一致的阴性和阳性结果。
包括IgM的动态变化存在个体差异、个体免疫存在异质性和非急性期低水平的IgM阳性结果。
IgM的动态变化存在个体差异:IgM作为急性期感染的特征性抗体,通常在急性感染的最初1~3个月,可以检测到中等至高水平的IgM抗体,此后开始下降,一般在出现后3~6个月转阴,但有患者在感染6~9个月后仍可检测出IgM阳性,部分患者在度过急性期后IgM抗体还会以低水平阳性持续存在。
个体免疫存在异质性:人体对病原体感染的免疫反应不同,抗体水平和变化规律存在个体差异,采用统一的参考范围和判断标准会出现临床上呈现的”假阳性”情况。
非急性期低水平的IgM阳性结果可能与个体免疫特性有关:IgM抗体动态监测反复出现低水平的阳性,是困扰临床的常见情况,易误导临床按急性感染期对待。持续低水平的IgM阳性结果与个体免疫特性有关,在急性感染期后可持续长达1年以上;不排除RF、甲状腺相关抗体等自身抗体或交叉反应导致的假阳性。
德国维润赛润TORCH原料
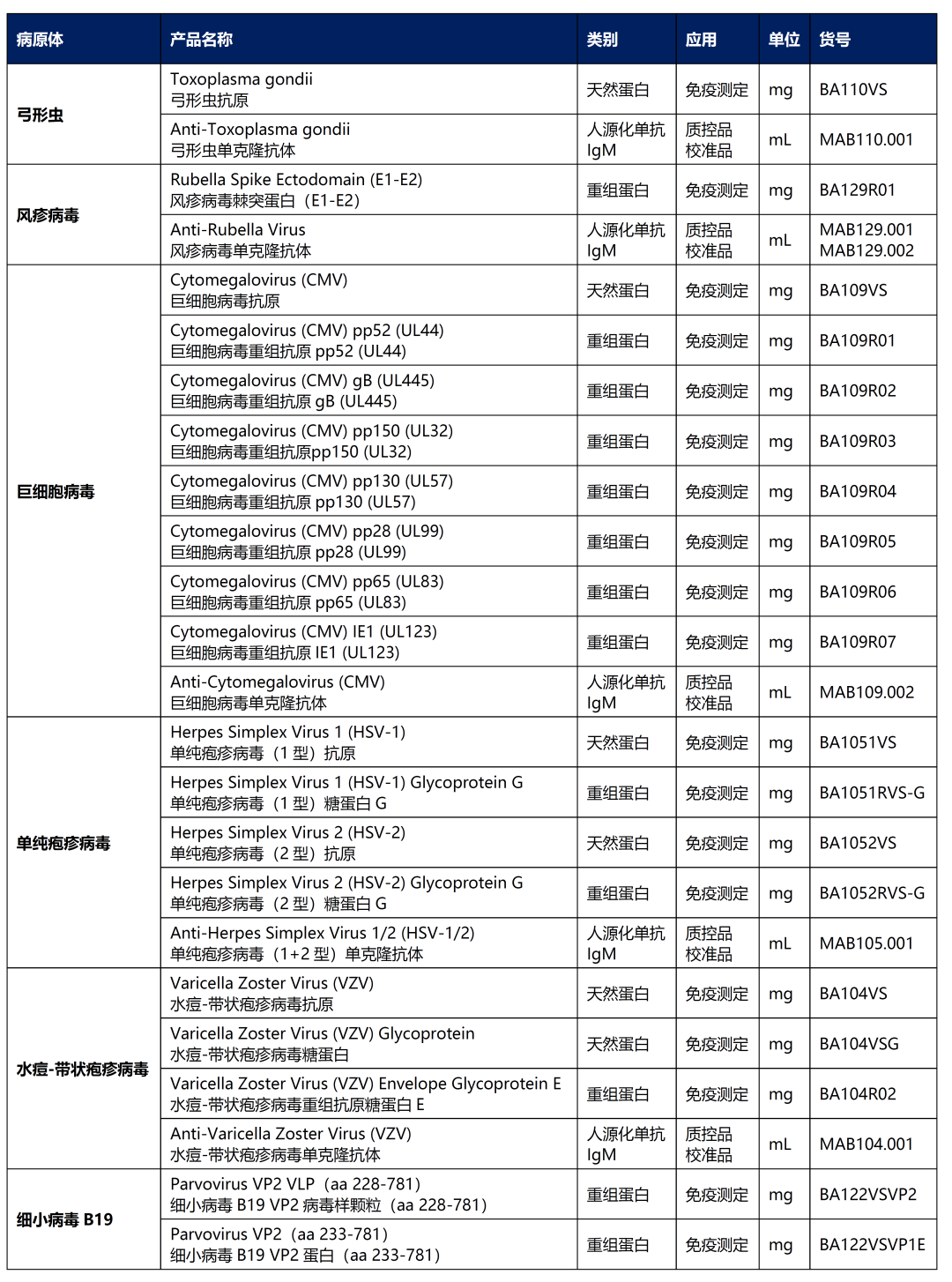
参考来源:孕前及妊娠期TORCH血清学IgM阳性的实验室对策
公司简介

助力我们的客户更加强大
永葆我们的价值无可替代






