
首先我们应该明确溯源的基本原则,对于有国家标准品的,必须溯源到国家标准品;对于没有国家标准品,但是有国际标准品的,必须溯源到国际标准品;对于两者都没有的,建议溯源到市场上该项目销量最好的、检验科比较认可的厂家,通俗来讲如果罗雅贝西有的,尽量就溯源到这几大家。
然后就是校准品的不确定度引入的三大因素∶
1)瓶间差异
2)稳定性
3)定值过程。
这里挑几个大家比较关注的问题说明一下。
其次是稳定性。
工作校准品一般主要考虑的是冻融引入的不确定性,产品校准品则主要考虑运输环境引入的不确定性。不管哪种,这都是需要在出厂前充分考虑到的。
定值引入的不确定性。
这个因素倒是不用提醒大家,因为大家几乎都会运用,但是令人失望的是,很多厂家在计算不确定度的时候,只会计算这个,却忽略了前面两个因素。而且对于定值引入的不确定度的计算,也是很片面的,比如对于适用机型有两个以上的,并没考虑仪器的适配性;或者对于同一型号的仪器,并无考虑仪器间的差异;对于试剂,并无考虑批间差异;对于人员,并无考虑操作差异;对于环境,并无考虑室间差异等等。
我说的这些大家可能觉得太麻烦了,但是实际上校准品的系统性评价的的确确是应该这样进行的。试想如果国家或者国际校准品没有严格的评判标准,又怎能让全世界的厂商来使用呢?如果我们实在想忽略其中的一些过程,就需要拿真实的数据来证明。
但是话又说回来,国内的试剂厂商,能把定值引入的不确定度认真负责一些,就已经很不错了,对此,我只能表示很无奈。
我们在选定一个口碑较好的竞品厂家给自己工作标准品定值的时候,很多人不知道如何计算竞品试剂引入的不确定度。要知道,我们的校准品不只是一个,每个浓度点都需要计算各自的不确定度,因此我们就需要把各个浓度点附近的临床样本用竞品试剂多测试几次就够了,如果cv在可接受的程度,那该定值过程引入的不确定度即可作为竞品在该点引入的不确定度。
目前国家对于临床样本的管控确实过于严格,我们只允许工作校准品用真实的临床样本来制备,产品校准品由于涉及大量销售,就不得不采用可替代物。对于重组的抗原抗体或者兔多抗,运用的时候最主要考虑的就是回算结果的真实性。举个例子,比如我们用工作校准品定标的试剂和用产品校准品定标的试剂,光溯源做的漂亮是没什么用的,溯源完成还需要用临床样本来做最终的复核,比如用40例以上的浓度覆盖整个检测区间的样本同时检测两个试剂,做直线拟合,看线性系数和截距是否在可接受范围。保障临床样本检测的准确性,才是溯源的最终目的。
换句话说,如果我按照国际标准品来溯源,最终测试临床样本的结果和罗雅贝西偏差比较大,我该怎么办?只能这么说,国际标准品不见得有临床指导意义,但是罗雅贝西有,你以为这些年几大试剂厂商的临床是白做的?所以干脆用大厂家的定值样本来当你的工作校准品反而更利于你后续的销售,但是注册资料还是照本宣科地该怎么写还是怎么写。除非你做到迈瑞这种影响力,大到可以自立门户了,非得用国际校准品建立另一套系统,那也无可厚非。但是你知道吗,有可能做国际标准品的那些人,就是罗雅贝西的人。
怎么说呢,理论上肯定是可以的,但是这是种井底之蛙,自欺欺人的做法,注册资料可以这么写,试剂研发还是悠着点,别以为自己的发光产品做的有多优秀。
德国维润赛润质控品/校准品系列原料
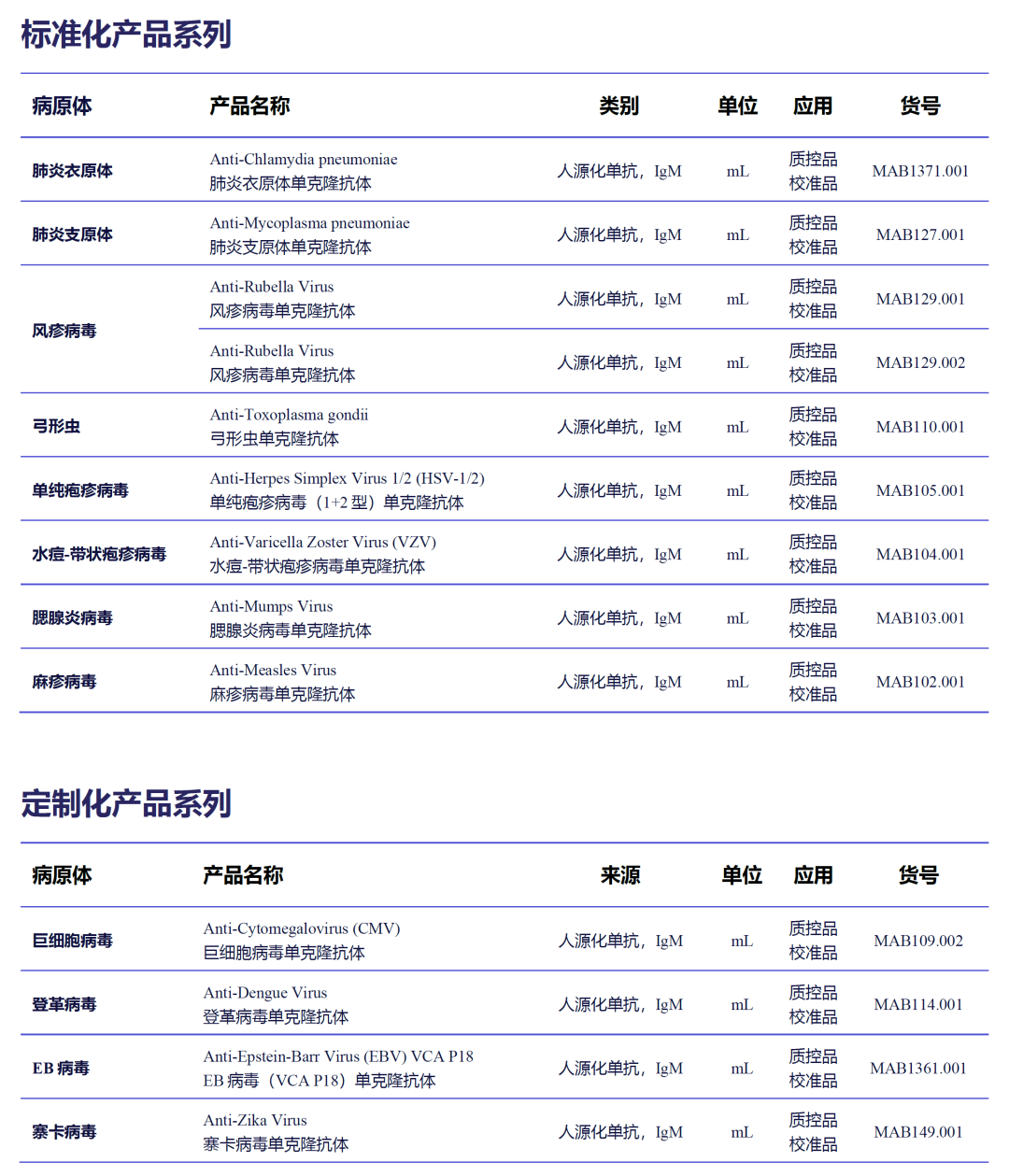

公司简介

德国维润赛润(Institut VirionSerion GmbH)成立于1978年,是国际知名的诊断产业原料生产商和供应商。公司的研发和生产基地位于德国维尔茨堡,已通过DIN EN ISO 13485质量体系认证,拥有三级生物安全实验室(P3实验室)。经过了40余年的发展,公司构建了丰富的生物原料产品线,主要包括天然抗原、重组抗原、人源化单克隆抗体和磁珠等。
助力我们的客户更加强大
永葆我们的价值无可替代

免责声明:本文仅代表作者本人观点,不代表维润赛润资讯的观点和立场。文章图片均来源于网络,如有侵权,请联系作者删除,欢迎联系小编。




