
引用本文:中华医学会感染病学分会儿科感染学组, 国家卫生健康委能力建设和继续教育儿科专委会感染组, 中国临床实践指南联盟方法学专委会, 等. 中国百日咳诊疗与预防指南(2024版) [J] . 中华医学杂志, 2024, 104(15) : 1258-1279. DOI: 10.3760/cma.j.cn112137-20240124-00179.
通信作者:曾玫,复旦大学附属儿科医院感染传染科 国家儿童医学中心(上海),上海 200032,Email:zengmeigao@aliyun.com;邵祝军,中国疾病预防控制中心传染病预防控制所,北京 102206,Email:shaozhujun@icdc.cn;张文宏,复旦大学附属华山医院感染科 国家传染病医学中心,上海 200040,Email:zhangwenhong@fudan.edu.cn;夏君,宁波诺丁汉大学GRADE中心,宁波 315100,Email:jun.xia3@nottingham.ac.uk.


百日咳再现的原因复杂,包括医务人员对百日咳知晓关注度的提高、症状监测敏感度的提高、聚合酶链式反应(polymerase chain reaction,PCR)等检测技术的应用、自然感染和疫苗接种均不能诱导终生免疫和菌株变异等[10-11];同时,我国还存在百日咳鲍特菌耐药率高的问题[12]。2017年国内发起“中国百日咳行动计划”,对进一步推动我国百日咳防控提出技术建议和应对策略[13]。为解决我国关于百日咳诊断、治疗、预防尤其是疫苗免疫策略的一系列优先问题,并规范临床和免疫接种实践,中华医学会感染病分会儿科感染学组、中国疾病预防控制中心(Centers for Disease Control and Prevention,CDC)传染病预防控制所、国家儿童医学中心(上海)、国家传染病医学中心联合国内领域专家于2022年发起制订我国百日咳诊疗和预防实践指南。
此外,GDG认为:虽然个别临床问题重要,但是不适合应用常规的证据质量评级的方法来评价。对于这类问题GDG形成基于专家共识的推荐意见,即良好实践主张(good practice statement,GPS)的方式表达。
GDG通过讨论确定了12个重要的临床问题,利用人群、干预、比较、结果(population,intervention,comparator,outcomes,PICO)格式将8个问题转化为研究问题,然后开展系统评价,该指南共制作了8个系统评价。10位GDG核心专家与方法学专家和系统评价团队进行了3次线上讨论,全面回顾和详细评估每个PICO问题的研究证据,通过讨论(为主)和投票(为辅)对推荐意见达成共识,初步形成推荐意见。推荐意见初稿通过问卷投票的方式提交给39位专家组成员进行审阅和评议,全体GDG就推荐意见及其实施建议达成共识。每1条推荐意见需获取至少80%的支持票即为通过。
系统评价员两人一组独立进行文献筛查和数据提取,若遇分歧,则由第三位系统评价员协助解决。采用Cochrane偏倚风险评估工具(risk of bias tool,1.0版)对纳入的随机对照试验(randomized controlled trial,RCT)进行偏倚风险评价[16];采用纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)对纳入的观察性研究(队列研究)进行偏倚风险评价[17];采用美国国立卫生研究院针对自身前后对照研究的偏倚风险评估工具[18],对此类研究进行偏倚风险评价。
默认使用RevMan 5.3软件采用固定效应模型进行荟萃分析,但针对非对照单臂研究,则使用R 4.0.2软件(meta包)采用随机效应模型进行数据合并。二分类结局的效应值采用风险比(risk ratio,RR)及其95%置信区间(confidence interval,CI);连续性结局的效应值采用均值差(mean deviation,MD)及其95%CI。进行荟萃分析前,充分考虑研究间的临床和方法学异质性,针对不能整合的研究结果进行描述性分析。当χ2检验P<0.1且I2>50%,则认为荟萃分析结果的差异有统计学意义,需进行亚组分析,探索潜在异质性的来源。
本指南的检索策略、纳入研究筛查流程图、纳入研究基线特征表、数据分析结果-森林图等相关具体信息,可登录网址(http://www.guidance.org.cn/index.php/guidelinewhoopingcough2024/news/)进行查看。
文献回顾:百日咳典型咳嗽症状是病例诊断的重要标准之一。中国CDC(2007年)、WHO(2018年)、美国CDC(2020年)、欧洲CDC(2018年)、澳大利亚卫生部(2014年)发布的百日咳监测方案中,都将咳嗽≥2周并伴有阵发性痉挛性咳嗽、咳嗽末吸气相回声、咳嗽后呕吐症状之一作为临床病例诊断的标准之一[19-23]。WHO、美国和欧洲CDC及我国均将呼吸暂停发作作为临床诊断百日咳病例(主要是婴儿,美国则不限于婴儿)的标准之一。但是,以上4种百日咳典型症状也见于非百日咳病例中[24-27]。我国近年来报道的儿童百日咳确诊病例中,78.4%~97.9%的患儿表现有阵发性痉挛性咳嗽,24.7%~60.9%有咳嗽末吸气相回声,26.5%~69.2%有咳嗽后呕吐,28.1%~44.1%(见于小婴儿)有呼吸暂停[26,28-32]。1项系统综述的结果显示,阵发性痉挛性咳嗽、咳嗽后呕吐、咳嗽末吸气相回声对于成人和儿童百日咳病例诊断的灵敏度分别为88%和75%、35%和55%、17%和43%,特异度分别为26%和47%、80%和66%、82%和84%[33]。伊朗1项研究显示,6~14岁学龄期儿童中,咳嗽≥2周,伴有1种、2种或3种典型百日咳的咳嗽症状(WHO病例定义标准)的患儿,PCR确诊的灵敏度和特异度分别为95.2%和15.0%、81.0%和60.3%、9.5%和91.2%[24]。
欧美、澳大利亚将符合临床标准且有流行病学接触史的病例视为临床诊断病例,我国则视为疑似病例。2020年美国CDC将咳嗽持续任意时间长短、咳嗽具有一种百日咳典型症状且接触过实验室确诊病例的患者也视为临床诊断病例。国内的研究也显示:咳嗽≥2周并不适合作为百日咳临床诊断标准之一。国内研究报道了193例细菌培养或荧光定量PCR检测确诊的百日咳儿童病例中有151例咳嗽<2周,133例具有至少一种典型百日咳样咳嗽;另有42例咳嗽>2周,但缺乏典型百日咳的咳嗽症状[32]。上海[28]、浙江[30]研究均报道了咳嗽<2周的病例约占百日咳确诊病例的36%。
此外,我国2007版百日咳诊断标准将疑似病例同时有外周血白细胞计数及淋巴细胞比例明显增高作为临床诊断的百日咳病例[19]。白细胞和淋巴细胞数量增多与细菌分泌的百日咳毒素数量有关,一般见于婴幼儿病例。白细胞和淋巴细胞在疾病早期升高,阵发性咳嗽期达到峰值,而年长儿、青少年和成人这一特征并不明显[25,34]。外周血白细胞计数及淋巴细胞明显增高可以高度提示百日咳,但其临床诊断价值与检测时机、病程和患者年龄有关,而且也可见于非百日咳病例中[35-36]。国内上海[28]、重庆[29]、浙江[30]报道的百日咳病例在确诊时或者住院期间,有34.7%~90.7%的病例有外周血白细胞增多症,61.7%~73.7%有淋巴细胞增多症。
推荐理由:开展实验室检测对于病例报告的准确性、病例早期诊断、不典型病例诊断尤其是接种过疫苗的儿童、青少年和成人病例很重要。GDG一致建议在我国百日咳病例被大大低估和漏报的现况下,百日咳疑似病例和临床诊断病例应尽可能在条件具备的医院接受实验室检测,提高我国百日咳诊治和防控水平。早期诊断有助于早期启始有效的抗感染治疗,百日咳患者在发病7 d内接受有效抗菌药物治疗可以减轻咳嗽症状[37]、2周内尤其是7 d内治疗可以缩短咳嗽时间[38],发病2周内治疗可以明显减少继发传播[37,39-40],接受敏感抗菌药物治疗可以减少肺炎并发症[38]、有可能降低3月龄以下小婴儿百日咳病例的病死率[41]。
文献回顾:2项中国研究,其中北京的研究基于406例符合临床诊断标准的百日咳患儿的检测结果分析显示,细菌培养和荧光定量PCR检测的灵敏度分别为27.1%和51.5%,特异度分别为79.0%和59.0%[32]。河北的研究基于94例符合临床诊断标准的百日咳患儿的检测结果分析显示,细菌培养和PCR检测的敏感度分别为61.70%和 86.17%,特异度分别为92.96%和71.83%;不符合临床诊断标准的71例患儿中,5例细菌培养阳性,20例PCR阳性[42]。WHO、美国CDC和欧洲CDC均将从咳嗽患者临床标本中分离出百日咳鲍特菌或PCR检测出百日咳鲍特菌作为百日咳的实验室确诊依据[20,43-44]。
WHO[20]和欧洲CDC[44]还将血清PT抗体检测作为确诊百日咳的依据,但是有一定条件的限制。WHO推荐血清PT-IgG升高可用于确诊百日咳,但是适用于≥11岁且1年内未接种过百日咳疫苗的患者,同时还强调PT-IgG抗体的单次测定需要使用WHO百日咳人血清标准品(06/140)和WHO百日咳抗血清标准品(06/142)进行标定。欧洲CDC也建议将血清学方法检测PT-IgG水平用于百日咳的实验室诊断,对于咳嗽≥2~3周的百日咳病例诊断最有效,尤其对于年长儿、青少年和成人更为适用[44]。一般采用酶联免疫吸附法(ELISA)或多重免疫测定法(multiplex immunoassays,MIA),PT-IgG抗体水平为100 U/ml或125 U/ml可作为1年内近期感染的临界值,介于50~100 U/ml可作为过去几年内感染的临界值。丹麦、荷兰和英国等研究表明,血清PT-IgG抗体单次临界值在60~75 U/ml时,诊断百日咳现症感染的灵敏度和特异度最佳[44]。我国天津1项研究显示,260例临床诊断的百日咳病例同时采集了鼻咽拭子和血标本,鼻咽拭子PCR阳性率为50.76%;血清PT-IgG阳性率为58.46%(PT-IgG浓度>80 U/ml者为近期感染,>30 U/ml为阳性;PT-IgM浓度>14 U/ml为阳性),阳性病例的病程[M(Q1,Q3)]为21(15,30)d,血清PT-IgM阳性率为17.59%,阳性病例的病程为6(5,16)d;血清PT-IgG抗体和鼻咽拭子PCR核酸检测的一致率为20%[45]。
WHO[20]和美国CDC[43]推荐,咳嗽2周以内的患者,实验室诊断首选细菌培养法(最好于抗菌药物使用前检测,检出率可达60%)和PCR法;尽管PCR法对咳嗽3周之后的患者的检出率开始下降,但对于咳嗽2~4周的患者,仍首选PCR法,辅以血清学方法。咳嗽4~12周的患者,首选血清学方法,主要检测血清PT-IgG抗体。血清学方法对于婴儿及1年内接种过含百日咳成分疫苗的病例检测意义不大,不能区分婴儿体内的母传抗体和接种疫苗诱导的抗体,推荐适用于3岁以上儿童(1年内未接种过含百日咳成分疫苗)、青少年和成人病例。
推荐理由:基于国际权威组织制订的百日咳实验室诊断标准和国内研究,PCR核酸检测用于百日咳诊断的灵敏度高且快速,在医院实验室容易开展。因此,GDG一致认为我国应将PCR核酸检测和百日咳鲍特菌培养用于百日咳病例的实验室确诊。血清抗体检测不能区分母传抗体、近期疫苗接种或者既往感染产生的抗体,临床需要结合病例的临床症状和病程、疫苗接种史进行专业分析解读,双份血清抗体检测不能满足百日咳及时诊断的需要,同时不能区分近期疫苗接种产生的抗体滴度升高,因此血清学诊断在临床实际应用中受限,不作为优先推荐。
文献回顾:有2项研究探讨了呼吸道标本种类对百日咳鲍特菌的分离培养的影响:1项美国研究显示,鼻咽拭子的百日咳鲍特菌分离阳性率为95%,而咽拭子的阳性率仅为44%(相应的鼻咽拭子皆为阳性)[46];另1项克罗地亚的研究显示,鼻咽拭子和鼻咽吸取液的百日咳鲍特菌分离阳性率皆为73.9%,而咽拭子仅为17.0%(相应的鼻咽拭子皆为阳性)[47]。有1项研究专门探讨了不同材料的拭子(藻酸钙、涤纶和植绒)采集鼻咽部样品后对百日咳鲍特菌的分离培养和PCR的影响,发现藻酸钙拭子会抑制PCR反应,而3种材料的拭子都可用于百日咳鲍特菌的分离培养,并发现含炭的Amies运送液效果差[48]。1项研究比较不同运输温度(分别为-20、4、25和35 ℃)和运输介质[Regan-Lowe运送培养基、Regan-Lowe及半强度琼脂运送培养基、添加α-酮戊二酸、林可霉素和山莨菪碱的缓冲炭酵母提取物琼脂(BCYEαLA)运送培养基]对百日咳鲍特菌存活情况的影响,结果显示4 ℃时使用Regan-Lowe运送培养基运输百日咳鲍特菌存活率最高[49]。另1项研究显示,与4和-20 ℃相比,存储于-70 ℃悬浮液中的百日咳鲍特菌存活率更高[50]。
WHO关于百日咳(2018版)采样标本的推荐:咳嗽4周内,使用无菌的涤纶、人造丝或植绒拭子尽量采集双份鼻咽拭子(可使用鼻咽吸取液),一份用于细菌培养,另一份用于PCR检测。用于培养者需立即接种平板或者将鼻咽拭子放入Regan-Lowe运送培养基中(勿使用Amies或者通用运送液),室温放置,于24 h内送至实验室进行接种;仅用于PCR检测者则将鼻咽拭子置于无菌容器中(干或含通用转运液)转运至实验室;咳嗽4~12周内,则收集血清标本,用于抗体的检测[20]。美国CDC推荐:使用涤纶、人造丝或者植绒拭子,无菌采集鼻咽拭子后,若用于细菌培养,置于Regan-Lowe运送培养基或含炭的Amies运送管中,保存温度为2~8 ℃,并于24~72 h内运送;若仅用于PCR检测,则将鼻咽拭子置于无菌容器中(干或者含通用转运液),置于-20 ℃及以下冻存[51]。对于鼻咽吸取液,无菌吸取至少0.5 ml样品,置于防渗漏的无菌塑料管中,2~8 ℃保存,在72 h内运送至实验室,否则于-20 ℃及以下冻存。
推荐理由:GDG推荐采集鼻咽拭子和鼻咽洗液用于百日咳鲍特菌检测,鼻咽拭子采集方便,优先推荐。鼻咽拭子用涤纶、人造丝或植绒拭子,与WHO和美国CDC推荐相一致,标本保存温度以美国CDC为准,因为其推荐与大多数的研究结果一致。
证据总结:共纳入1项RCT研究[58]、1项非RCT研究[59]。1项RCT研究纳入477例美国和加拿大百日咳病例(114例细菌培养确诊为百日咳,52例经PCR和血清学检查确诊为百日咳,311例符合百日咳疑似病例的定义),年龄6个月~16岁,干预组239例使用阿奇霉素进行治疗(第1天口服,剂量为10 mg·kg-1·d-1;第2~5天口服,剂量为5 mg·kg-1·d-1,疗程共5 d),对照组238例使用红霉素进行治疗(口服,剂量为40 mg·kg-1·d-1,疗程共10 d)。结果显示,两组在治疗结束时,细菌培养结果阳性的患儿体内细菌均得以清除,组间差异无统计学意义(n=106,RR=1,95%CI:0.96~1.04,低把握度证据);治疗结束1周后,两组细菌复阳率为0(95%CI:0~7%)。实验室确诊的病例在治疗结束后,患儿咳嗽相关症状的患病率均有所下降,组间差异无统计学意义。干预组和对照组的阵发性痉挛性咳嗽症状发生率分别为67.5%和66.3%(n=106,RR=1.03,95%CI:0.79~1.34,低把握度证据),呕吐发生率分别为30.0%和24.4%(n=106,RR=1.23,95%CI:0.66~2.30,低把握度证据),呼吸暂停/发绀发生率分别为28.8%和25.6%(n=106,RR=1.07,95%CI:0.58~1.99,低把握度证据),痉挛性咳嗽发生率分别为41.3%和48.8%(n=106,RR=0.85,95%CI:0.56~1.29,低把握度证据)。阿奇霉素组不良事件的发生风险低于红霉素组(RR=0.38;95%CI:0.19~0.75),其中胃肠道不良事件风险减低54%(n=477,RR=0.46,95%CI:0.34~0.62,中等把握度证据)。阿奇霉素治疗组的服药依从性优于红霉素组,两组患儿完成所有治疗剂量的比例分别为90%和50%[58]。
1项日本非RCT研究纳入17例确诊病例,年龄0~13岁(<1岁的有10例),8例接受阿奇霉素治疗[口服,10 mg·kg-1·d-1,疗程5 d,发病后(14.1±3.3)d开始用药],9例接受克拉霉素治疗[口服,10 mg·kg-1·d-1,疗程7 d,发病后(11.8±7.2)d开始用药],每例患者与既往红霉素治疗(口服,40~50 mg·kg-1·d-1,疗程14 d)的对照组进行1∶2匹配(按照年龄、性别、疫苗免疫史、服药时病程),结果显示:治疗结束1周后,阿奇霉素组和红霉素组的细菌清除率分别为100%和81%,克拉霉素组和红霉素组的细菌清除率分别为100%和89%,而且治疗2周后均无细菌复阳,红霉素组在治疗2周后均未检测到细菌[59]。该研究显示,百日咳患儿接受5 d阿奇霉素或7 d克拉霉素治疗的预期效果等效于甚至优于14 d红霉素治疗。
其他因素:阿奇霉素在中国的临床应用范围较广,虽然缺少阿奇霉素和克拉霉素的对照研究,但由于其半衰期长、疗程短,且胃肠道不良反应的风险低,患儿服药依从性好,从家长和患儿的接受度、服药依从性考虑,阿奇霉素优于红霉素和克拉霉素,尤其是中国儿科医师和患儿家长更倾向于选择阿奇霉素(专家意见)。虽然未纳入经济成本效益的比较,但从全疗程治疗费用和服药不良反应相关的额外就诊来看,和对照组相比,阿奇霉素治疗组对医疗资源的消耗可能更低(专家意见)。此外,阿奇霉素优先推荐应用于新生儿,克拉霉素不推荐应用于新生儿[55]。
推荐理由:GDG根据临床研究证据分析认为阿奇霉素组疗程短,不良事件发生风险较低,在疗效相当的前提下比红霉素和克拉霉素更有优势,尤其为患儿带来的获益更明显。此外,阿奇霉素在中国的应用范围较广、可接受度以及患儿服药依从性均可能更优。综合分析,GDG认为阿奇霉素的临床应用比其他对照药物更具优势。
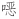 唑(磺胺甲
唑(磺胺甲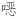 唑+甲氧苄啶)治疗(低把握度证据,强推荐);2月龄及以下婴儿建议选用头孢哌酮舒巴坦或哌拉西林他唑巴坦治疗,左氧氟沙星可以作为成人患者的替代选择。(极低把握度证据,有条件推荐)
唑+甲氧苄啶)治疗(低把握度证据,强推荐);2月龄及以下婴儿建议选用头孢哌酮舒巴坦或哌拉西林他唑巴坦治疗,左氧氟沙星可以作为成人患者的替代选择。(极低把握度证据,有条件推荐)
(2)复方磺胺甲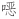 唑的治疗剂量和疗程参照国家卫生健康委印发的《百日咳诊疗方案(2023版)》[57]:≥2月龄儿童,磺胺甲
唑的治疗剂量和疗程参照国家卫生健康委印发的《百日咳诊疗方案(2023版)》[57]:≥2月龄儿童,磺胺甲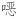 唑每次20 mg/kg,甲氧苄啶每次4 mg/kg;成人磺胺甲
唑每次20 mg/kg,甲氧苄啶每次4 mg/kg;成人磺胺甲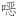 唑800 mg/次,甲氧苄啶160 mg/次,1次/(12 h),疗程均为14 d。其他替代抗菌药物的剂量按照药物说明书的常规推荐剂量,疗程10~14 d。
唑800 mg/次,甲氧苄啶160 mg/次,1次/(12 h),疗程均为14 d。其他替代抗菌药物的剂量按照药物说明书的常规推荐剂量,疗程10~14 d。
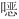 唑可引起肝、肾功能损害,治疗期间或结束后,监测尿常规及肝、肾功能,服药期间多饮水,以防结晶尿的发生,必要时可服用碱化尿液的药物。同时需注意是否诱发粒细胞减少、血小板减少,注意监测外周血细胞计数。(2)注意复方磺胺甲
唑可引起肝、肾功能损害,治疗期间或结束后,监测尿常规及肝、肾功能,服药期间多饮水,以防结晶尿的发生,必要时可服用碱化尿液的药物。同时需注意是否诱发粒细胞减少、血小板减少,注意监测外周血细胞计数。(2)注意复方磺胺甲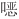 唑的禁忌证,包括:对磺胺甲
唑的禁忌证,包括:对磺胺甲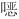 唑与甲氧苄啶过敏者、巨幼红细胞性贫血患者、妊娠期及哺乳期妇女、<2个月的婴儿、重度肝、肾功能损害者。(3)葡萄糖-6-磷酸脱氢酶缺乏症患者慎用,大剂量使用可能诱发溶血[60]。
唑与甲氧苄啶过敏者、巨幼红细胞性贫血患者、妊娠期及哺乳期妇女、<2个月的婴儿、重度肝、肾功能损害者。(3)葡萄糖-6-磷酸脱氢酶缺乏症患者慎用,大剂量使用可能诱发溶血[60]。
证据总结:共纳入1项RCT研究和4项观察性研究[54,61-64]。1项尼日利亚RCT研究比较了44例确诊为百日咳的患儿(年龄0~10岁)分别接受复方磺胺甲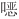 唑和四环素治疗7 d后的效果,结果显示:与使用四环素的患儿相比,每1 000例接受复方磺胺甲
唑和四环素治疗7 d后的效果,结果显示:与使用四环素的患儿相比,每1 000例接受复方磺胺甲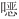 唑治疗的患儿中,症状改善(n=66,RR=1.13,95%CI:0.70~1.83)的患儿可能平均增加61例(95%CI:减少141例~增加391例);每1 000例接受复方磺胺甲
唑治疗的患儿中,症状改善(n=66,RR=1.13,95%CI:0.70~1.83)的患儿可能平均增加61例(95%CI:减少141例~增加391例);每1 000例接受复方磺胺甲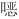 唑治疗的患者中,症状恶化(n=66,RR=0.53,95%CI:0.10~2.70)的患儿可能平均减少55例(95%CI:减少106例~增加200例);若阵咳发作7 d内用药,每1 000例接受复方磺胺甲
唑治疗的患者中,症状恶化(n=66,RR=0.53,95%CI:0.10~2.70)的患儿可能平均减少55例(95%CI:减少106例~增加200例);若阵咳发作7 d内用药,每1 000例接受复方磺胺甲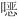 唑治疗的患儿中,可能平均减少66例(95%CI:减少129例~增加276例)症状恶化(n=47,RR=0.54,95%CI:0.10~2.93)的患儿;每1 000例接受复方磺胺甲
唑治疗的患儿中,可能平均减少66例(95%CI:减少129例~增加276例)症状恶化(n=47,RR=0.54,95%CI:0.10~2.93)的患儿;每1 000例接受复方磺胺甲 唑治疗的患儿中可能平均增加194例(95%CI:减少76例~增加709例)症状改善(n=47,RR=1.51,95%CI:0.80~2.86)的患儿[61]。以上结果均来自低把握度证据。
唑治疗的患儿中可能平均增加194例(95%CI:减少76例~增加709例)症状改善(n=47,RR=1.51,95%CI:0.80~2.86)的患儿[61]。以上结果均来自低把握度证据。
其他文献回顾:1项美国研究比较了50例百日咳确诊患儿(年龄2月龄~9岁,平均17月龄)在痉挛性咳嗽期接受氨苄西林、氯霉素、土霉素、红霉素(口服至少7 d)和不接受治疗的效果(每组入组观察10例病例),这4种药物在体外对百日咳鲍特菌具有抗菌活性,其中红霉素优于其他抗菌药物。结果显示:4种抗菌药物对百日咳患儿的病程影响的差异无统计学意义,红霉素、土霉素、氯霉素治疗组患儿细菌培养持续阳性的平均时长分别为0.6、2.7和3.4 d;其中2例接受氯霉素治疗的患儿、1例接受红霉素治疗的患儿和1例接受土霉素治疗的患儿,在停药后1~7 d内细菌培养复阳,未治疗组和氨苄西林治疗组患儿细菌培养持续阳性平均时长分别为11.3和17.8 d[62]。
1项德国研究比较了55例(年龄9月龄~11岁,平均3岁)细菌培养确诊为百日咳的患儿接受红霉素(28例)和复方磺胺甲 唑(27例)治疗2周的效果。结果显示:红霉素治疗组和复方磺胺甲
唑(27例)治疗2周的效果。结果显示:红霉素治疗组和复方磺胺甲 唑治疗组的细菌培养转阴率分别为100.0%和96.3%(1例未转阴性的患儿呕吐明显,可能影响药物疗效),差异无统计学意义[63]。
唑治疗组的细菌培养转阴率分别为100.0%和96.3%(1例未转阴性的患儿呕吐明显,可能影响药物疗效),差异无统计学意义[63]。
 唑、氨苄西林、氨苄西林舒巴坦、头孢呋辛、头孢曲松、头孢哌酮舒巴坦、哌拉西林或哌拉西林他唑巴坦的MIC90分别为0.38、0.25、0.19、12.00、0.19、0.05和<0.02 mg/L。在仅使用头孢哌酮舒巴坦(n=21)或哌拉西林他唑巴坦(n=11)一种抗菌药物治疗的患儿中,93.8%(30/32)的患儿临床症状改善;96.0%(24/25)的患儿在治疗2周后复查细菌培养为阴性。在使用红霉素(n=9)或阿奇霉素(n=6)治疗的患儿中,86.7%(13/15)的患儿临床症状改善,50.0%(4/8)的患儿在治疗2周后复查细菌培养为阴性[64]。该研究组的另1项研究又进一步比较了大环内酯类和β-内酰胺类抗菌药物治疗的敏感株和耐药株的疗效,疗程均为14 d。对于大环内酯类敏感株,大环内酯类的细菌清除率(30例)高于β-内酰胺类(17例),治疗14 d后鼻咽部细菌清除率分别80.0%和58.8%;出院后7 d鼻咽部细菌清除率分别96.7%和70.6%。对于大环内酯类耐药株,大环内酯类的细菌清除率(31例)低于β-内酰胺类(47例),治疗14 d后鼻咽部细菌清除率分别为22.6%和72.3%;出院后7 d鼻咽部细菌清除率分别为74.2%和95.7%。总体上,大环内酯类和β-内酰胺类药物治疗组病例在治疗2周后临床好转率分别为77.0%和82.8%,差异无统计学意义(P=0.42)[54]。
唑、氨苄西林、氨苄西林舒巴坦、头孢呋辛、头孢曲松、头孢哌酮舒巴坦、哌拉西林或哌拉西林他唑巴坦的MIC90分别为0.38、0.25、0.19、12.00、0.19、0.05和<0.02 mg/L。在仅使用头孢哌酮舒巴坦(n=21)或哌拉西林他唑巴坦(n=11)一种抗菌药物治疗的患儿中,93.8%(30/32)的患儿临床症状改善;96.0%(24/25)的患儿在治疗2周后复查细菌培养为阴性。在使用红霉素(n=9)或阿奇霉素(n=6)治疗的患儿中,86.7%(13/15)的患儿临床症状改善,50.0%(4/8)的患儿在治疗2周后复查细菌培养为阴性[64]。该研究组的另1项研究又进一步比较了大环内酯类和β-内酰胺类抗菌药物治疗的敏感株和耐药株的疗效,疗程均为14 d。对于大环内酯类敏感株,大环内酯类的细菌清除率(30例)高于β-内酰胺类(17例),治疗14 d后鼻咽部细菌清除率分别80.0%和58.8%;出院后7 d鼻咽部细菌清除率分别96.7%和70.6%。对于大环内酯类耐药株,大环内酯类的细菌清除率(31例)低于β-内酰胺类(47例),治疗14 d后鼻咽部细菌清除率分别为22.6%和72.3%;出院后7 d鼻咽部细菌清除率分别为74.2%和95.7%。总体上,大环内酯类和β-内酰胺类药物治疗组病例在治疗2周后临床好转率分别为77.0%和82.8%,差异无统计学意义(P=0.42)[54]。
 唑(MIC90:0.3 mg/L)均敏感[28,30,54,64-65]。研究显示复方磺胺甲
唑(MIC90:0.3 mg/L)均敏感[28,30,54,64-65]。研究显示复方磺胺甲 唑治疗百日咳的疗效、细菌清除率与红霉素的疗效相当[61,63],因此,优先推荐复方磺胺甲
唑治疗百日咳的疗效、细菌清除率与红霉素的疗效相当[61,63],因此,优先推荐复方磺胺甲 唑治疗大环内酯类耐药株感染的百日咳病例,作为我国2月龄以上儿童和成人百日咳经验治疗的一线选择。此外我国多地临床研究数据显示:临床分离的百日咳鲍特菌对氨苄西林(MIC90:0.25~0.75 mg/L)、庆大霉素(MIC90:1.5 mg/L)、左氧氟沙星(MIC90:0.5 mg/L)、哌拉西林(MIC90:<0.016 mg/L)、头孢哌酮舒巴坦(MIC90:0.047 mg/L)、氨苄西林舒巴坦(MIC90:0.19 mg/L)、头孢他啶(MIC90:0.19 mg/L)、头孢曲松(MIC90:0.094~0.190 mg/L)的MIC值与敏感的红霉素、复方磺胺甲
唑治疗大环内酯类耐药株感染的百日咳病例,作为我国2月龄以上儿童和成人百日咳经验治疗的一线选择。此外我国多地临床研究数据显示:临床分离的百日咳鲍特菌对氨苄西林(MIC90:0.25~0.75 mg/L)、庆大霉素(MIC90:1.5 mg/L)、左氧氟沙星(MIC90:0.5 mg/L)、哌拉西林(MIC90:<0.016 mg/L)、头孢哌酮舒巴坦(MIC90:0.047 mg/L)、氨苄西林舒巴坦(MIC90:0.19 mg/L)、头孢他啶(MIC90:0.19 mg/L)、头孢曲松(MIC90:0.094~0.190 mg/L)的MIC值与敏感的红霉素、复方磺胺甲 唑相似,提示体外敏感[30,64-65];现有的临床观察性研究显示:哌拉西林他唑巴坦、头孢哌酮舒巴坦治疗国内百日咳患儿的疗效优于红霉素和阿奇霉素[30,54,64]。国外早期研究未显示氨苄西林治疗百日咳患儿在细菌清除方面的获益[62]。因此,对于慎用或禁用复方磺胺甲
唑相似,提示体外敏感[30,64-65];现有的临床观察性研究显示:哌拉西林他唑巴坦、头孢哌酮舒巴坦治疗国内百日咳患儿的疗效优于红霉素和阿奇霉素[30,54,64]。国外早期研究未显示氨苄西林治疗百日咳患儿在细菌清除方面的获益[62]。因此,对于慎用或禁用复方磺胺甲 唑的病例,如2月龄以下、葡萄糖-6-磷酸脱氢酶缺乏症、严重过敏反应、肾损伤的患儿,推荐选择哌拉西林他唑巴坦或头孢哌酮舒巴坦作为替代治疗。对于成人患者,虽然缺乏临床疗效评价数据,但是根据国内体外药敏数据显示,左氧氟沙星对于百日咳鲍特菌敏感,可作为替代选择。
唑的病例,如2月龄以下、葡萄糖-6-磷酸脱氢酶缺乏症、严重过敏反应、肾损伤的患儿,推荐选择哌拉西林他唑巴坦或头孢哌酮舒巴坦作为替代治疗。对于成人患者,虽然缺乏临床疗效评价数据,但是根据国内体外药敏数据显示,左氧氟沙星对于百日咳鲍特菌敏感,可作为替代选择。
推荐理由:对于治疗大环内酯类耐药的百日咳病例,现有研究证据相对匮乏,证据体质量低。有限的数据显示,相较于四环素,复方磺胺甲 唑的疗效可能稍有优势;大环内酯类和β-内酰胺类药物疗效可能相当。结合我国大环内酯类药物耐药率高的现状,GDG认为对大环内酯类药物耐药的百日咳患者,2月龄以上儿童和成人应首选复方磺胺甲
唑的疗效可能稍有优势;大环内酯类和β-内酰胺类药物疗效可能相当。结合我国大环内酯类药物耐药率高的现状,GDG认为对大环内酯类药物耐药的百日咳患者,2月龄以上儿童和成人应首选复方磺胺甲 唑;2月龄以下婴儿可以选用头孢哌酮舒巴坦或者哌拉西林他唑巴坦。今后需要开展高质量的研究进一步评价体外敏感的抗菌药物治疗百日咳患者的临床疗效。
唑;2月龄以下婴儿可以选用头孢哌酮舒巴坦或者哌拉西林他唑巴坦。今后需要开展高质量的研究进一步评价体外敏感的抗菌药物治疗百日咳患者的临床疗效。
证据总结:共纳入2项队列研究,纳入对象为实验室确诊的重症百日咳患儿,外周血白细胞值均>50×109/L。中国研究纳入72例患儿(发病年龄12 d~5.6岁),17例换血组患儿中有7例(41.2%)死亡,55例非换血组中死亡5例(9.1%),换血组病死率高于非换血组(P=0.006)[66]。美国研究纳入25例收入儿童重症监护病房(intensive care unit,ICU)的危重症患儿[中位年龄49 d(<1周~38周),3月龄以下患儿占83%)],外周血白细胞值均>50×109/L,其中13例干预组(包括12例换血疗法,1例白细胞去除术)中有5例死亡,12例未干预组中有3例死亡,差异有统计学意义(P<0.05)[67]。
观察性研究数据显示换血组比未换血组的死亡风险有轻微升高(n=97,率差=0.26,95%CI:0.06~0.46),平均每1 000例增加219例患者死亡(95%CI:增加41例~增加592例,极低把握度证据)。由于2项观察性研究偏倚风险高,因此GDG对上述组间差异把握度极低。患者的一些临床指标的基线风险可能不同,例如病情更加严重、病死风险更高的患者入选换血组的可能性更大,因此换血组所显示的治疗效果不一定是干预措施的直接后果。
其他因素:重症百日咳患儿伴有高白细胞血症是死亡的危险因素,近10多年国内外的文献报道伴有高白细胞血症的重症百日咳患儿的病死率在10%~50%[66-69]。美国1项研究回顾性研究分析了1998至2014年因百日咳住院的236例、年龄<120 d的婴儿(53例死亡,183例存活),结果显示:外周血白细胞计数>30×109/L的危重症患儿的死亡风险增高(OR=199.5,95%CI:26.6~1 495.8)[41];国内1项研究显示重症百日咳患儿外周血白细胞计数>30×109/L的死亡校正风险比为63.708(95%CI:3.574~1 135.674)[31]。美国研究对ICU收治的127例危重症百日咳患儿(中位年龄49 d,<3月龄的患儿占比83%)的分析显示,外周血白细胞计数>50×109/L的患儿的相对死亡风险是白细胞计数<50×109/L的患儿的9.8倍(95%CI:2.8~34.3)[67]。百日咳死亡病例的婴儿肺组织病理结果显示,肺小动脉、静脉和淋巴管腔内有大量白细胞聚集,这些患儿均有高白细胞血症(13例死亡患儿的外周血白细胞计数范围:34.6×109/L~117.6×109/L,其中11例患儿的白细胞计数>50×109/L),白细胞大量聚集可引起肺血管阻力增加,导致肺动脉高压和血流动力学衰竭,最终患儿可因低氧血症和难治性休克而死亡[34,70];其次,外周血白细胞计数增高可使血液黏度增高。故换血疗法可以降低外周血白细胞。
作为一种治疗新生儿严重高胆红素血症的方法,换血疗法的安全性较好,在治疗伴高白细胞血症的危重症百日咳患儿的临床实践中受到一定关注。白细胞单采对于操作和设施要求较高,对体重<6 kg的婴儿来说,具有较大的实施难度,并可导致严重的并发症,并非临床常规开展的技术。白细胞去除术可增加卫生资源的消耗,直接治疗费用较高,目前尚无证据证明该疗法的成本效果状况。
GDG根据经验反馈,认为白细胞去除术的利弊平衡存在较大的不确定性,患儿家长的接受治疗意愿也不一致,并且该疗法的实施对医疗机构的设备和医护人员的专业水平要求较高,会导致其临床可及性和及时实施性较差。此外,起始治疗的时机很可能与预后有关,1项基于接受换血疗法或者白细胞过滤治疗的10例百日咳死亡患儿的病例系列分析发现,5例死亡病例均伴有肺动脉高压、低血压/休克和肺炎,4例并发脏器功能衰竭,而5例存活病例未并发低血压/休克和脏器功能衰竭[69]。因此,GDG认为换血疗法应在患儿脏器功能衰竭前或者休克/低血压发生时即刻进行,可能临床获益。
推荐理由:2004至2017年国内外文献累计报道56例接受换血疗法的重症百日咳患儿(年龄:15 d~17月龄;外周血白细胞计数范围:45×109/L~135.4×109/L)的总病死率高达32.1%[71]。目前基于观察性研究的证据偏倚风险高,GDG对研究结果所显示的疗效和安全性的把握度低。现有证据不确定换血疗法相关的临床获益,甚至病死风险有升高的可能性。结合换血疗法的治疗成本、可及性、可接受度等方面,GDG认为若重症百日咳患儿伴有高白细胞血症(白细胞至少>30×109/L)而无并发肺动脉高压,使用换血疗法很可能是弊大于利。尽管换血疗法的治疗效果不太确定,但是对于重症婴幼儿百日咳病例,当外周血白细胞计数>50×109/L,或者外周血白细胞计数>30×109/L伴有肺动脉高压,医师可以根据患儿的具体情况、疾病进展、现有的医疗资源等进行专业判断,实施干预方案。
证据总结:纳入1项RCT研究和3项非RCT研究。1项新西兰的RCT研究纳入11例临床诊断的百日咳患儿,年龄均<6月龄,均无并发症,7例激素组给予地塞米松(0.3 mg·kg-1·d-1,连用4 d),4例对照组给予安慰剂治疗,2组均接受红霉素治疗(40 mg·kg-1·d-1,连用14 d)[73];1项意大利的非RCT研究纳入11例百日咳患儿,7例[年龄(2.5±2.1)岁]接受倍他米松治疗(0.08 mg·kg-1·d-1,3次/d,连用10 d),4例[年龄(6.2±2.7)岁]接受安慰剂治疗[74];1项中国的非RCT研究纳入70例重症百日咳伴有窒息的患儿(年龄26 d~7个月),住院治疗前病程<3周,对照组使用红霉素、庆大霉素或氨苄青霉素治疗,干预组在此基础上联用静脉滴注氢化可的松(8~10 mg·kg-1·d-1)或氟美松(0.25~0.50 mg·kg-1·d-1),3~5 d后减量,7~9 d停用[75]。1项希腊的非RCT研究纳入137例百日咳患儿(年龄15 d~3岁,无论疾病严重程度),住院前平均病程<2周,在痉挛性咳嗽第1周,67例对照组仅使用红霉素(40 mg·kg-1·d-1,连用10 d)治疗,70例治疗组使用红霉素联合氢化可的松(第1~2天:30 mg·kg-1·d-1,然后逐渐减量,第7~8天停用)治疗[76]。
上述4项研究显示,与不使用糖皮质激素组相比,联用糖皮质激素组的患儿症状持续时间有所减少,如窒息持续时间减少6 d(n=70,MD=-6,95%CI:-7.65~4.35,低把握度证据)[75],咳嗽持续时间减少8.67 d(n=207,MD=-8.67,95%CI:-10.11~-7.23,极低把握度证据)[75, 76],百日咳症状持续时间减少4.5 d(n=137,MD=-4.5,95%CI:-5.79~-3.21,极低把握度证据)[76]。同时,痉挛性咳嗽发作次数也有所减少,用药5 d后减少4.7次(n=11,MD=-4.70,95%CI:-7.35~-2.05,低把握度证据),用药后10 d减少6.7次(n=11,MD=-6.70,95%CI:-9.83~-3.57,低把握度证据)[74]。随访未发现激素相关的不良反应,复发、治愈和治疗后并发症(肺炎)方面的差异无统计学意义。
另有1项英国的非RCT研究纳入36例百日咳病例(年龄14 d~8岁),27例患儿接受吸入性激素布地奈德(剂量:<2岁,500 μg;>2岁,1 mg,连用2次/d),6例未接受激素吸入治疗。结果显示:与对照组相比,激素吸入24 h内窒息症状均得以缓解,激素治疗后72 h咳嗽有所改善[77]。
其他因素:目前虽然缺乏激素治疗的成本效果分析研究的证据,但是激素直接治疗的成本在中国的卫生体系中所占比例不高,不会对卫生体系和患者产生较大的经济负担。此外,有少数家长或患者可能会担心激素的不良反应,但是短程常规剂量的激素治疗对于绝大多数患者和患儿家长而言是可行和可接受的。
推荐理由:目前尚无研究证据显示激素治疗对关键临床指标(如病死率等)带来根本的治疗获益,但是在百日咳痉挛性咳嗽期接受激素治疗,可能减轻症状并加快症状缓解,如窒息持续时间、痉挛性咳嗽发作次数、咳嗽持续时间等可能会降低,这对百日咳患者的病情改善很重要,直接影响患者的生活质量和治疗效果,所以GDG认为症状减轻和缓解可视为中等程度的临床获益。研究证据未发现短程激素治疗的损害,且GDG根据临床经验也一致认为短期激素使用导致不良事件的概率极低。因此,虽然证据质量低,但是GDG推荐痉挛性咳嗽期抗感染药物联合短程激素治疗。今后应开展更高质量、同质性临床研究再评价激素治疗百日咳的获益。
 唑,连用10~14 d。如果密接者年龄<2月龄或使用磺胺类药物有禁忌证,在传染病专科医师指导下采取个体化抗菌药物预防建议。(4)该推荐意见适用于个体的预防干预,而非公共卫生角度的社区人群层面的预防干预。
唑,连用10~14 d。如果密接者年龄<2月龄或使用磺胺类药物有禁忌证,在传染病专科医师指导下采取个体化抗菌药物预防建议。(4)该推荐意见适用于个体的预防干预,而非公共卫生角度的社区人群层面的预防干预。
证据总结:共纳入3项RCT研究,分别来自美国医务人员暴露[78]、英国[79]和加拿大[80]的家庭成员暴露。纳入6项队列研究分别来自西班牙[79]、美国[37,39-40]、德国[80]和加拿大[81],其中1项是在残疾人护理院暴露[37],其他均为家庭内暴露。2项RCT研究[79-80]和5项队列研究[37,39-40,82-83]使用红霉素进行预防性治疗,疗程10~14 d,1项RCT研究[78]和1项队列研究[81]使用阿奇霉素进行预防性治疗,疗程5 d。
2项RCT研究结果提示:与安慰剂组相比,家庭成员暴露后接受红霉素预防组继发细菌培养确诊的百日咳的风险减少33%(n=391,RR=0.67,95%CI:0.25~1.78,中等把握度证据),接受红霉素预防组继发临床诊断的百日咳的风险减少4%(n=347,RR=0.96,95%CI:0.40~2.27,中等把握度证据)[79-80]。1项英国RCT研究报道接种疫苗的儿童未继发百日咳(包括32例红霉素预防组和28例安慰剂组,RR不可估计),而未接种疫苗的接触儿童的百日咳继发发病率在预防组和安慰剂组间的差异无统计学意义[20%(4/20)比18%(2/11),RR=1.10,95%CI:0.24~5.08][79]。Halperin等[80]报道虽然红霉素预防家庭内发生细菌培养确诊的百日咳发生率低于安慰剂组,预防培养确诊百日咳病例的有效率为67.5%(95%CI:7.6%~88.7%),但是差异无统计学意义[2.1%(3/142)比5.1%(8/158),RR=0.42,95%CI:0.11~1.54];预防组和安慰剂组在预防经细菌培养确诊的病例或临床诊断病例间的差异无统计学意义[4.8%(6/124)比6.1%(8/132),RR=0.80,95%CI:0.29~2.24]。1项美国针对4年内接种DTaP疫苗的医务人员RCT研究显示,42例接受阿奇霉素预防治疗组和44例未治疗组中,分别有1例(2.5%)和4例(9.1%)发生血清学或者PCR诊断的无症状百日咳感染患者(绝对风险差=-6.7%;单侧95%CI下限=-14.8%;P=0.54)[78]。
西班牙队列研究显示,密接者在原发病例发病后21 d内接受阿奇霉素预防治疗百日咳(症状)的总有效率为43.9%,≤18岁患儿治疗的有效率为44.1%,7 d内预防的有效率为82.3%,8~14 d内预防的有效率为46.4%,15~21 d内预防的有效率为11.8%,>21 d后预防无效;全程接种4剂次疫苗的18岁以下儿童的有效率是44.1%(95%CI:-59.5%~80.4%),未全程接种疫苗的儿童的有效率是50.0%(95%CI:-248.0%~92.8%),差异均无统计学意义[81]。早期家庭内和护理机构内的观察性研究也发现:接触者在暴露原发病例2~3周内接受红霉素预防治疗,可以减少继发感染率,而3周后给予药物预防治疗的继发感染率高[37,39-40]。1项加拿大的队列研究报道了红霉素预防家庭内暴露百日咳的治疗效果,预防组和未预防组家庭成员的继发百日咳的发病率分别为17%和25%(RR=0.69,95%CI:0.52~0.93),且不随年龄和疫苗接种情况而变化;在家庭内出现继发百日咳病例前,家庭成员进行预防治疗的效果比在家庭内出现继发百日咳病例后其他家庭成员进行预防治疗的效果更好,两组的继发发病率分别为4%和35%(RR=0.11,95%CI:0.06~0.22)[83]。
1项RCT研究报道:红霉素预防组与安慰剂组相比,安慰剂组的不良事件发生率下降(34.0%比15.7%,RR=2.17,95%CI:1.43~3.31),包括腹泻(n=310,RR=2.39,95%CI:1.31~4.34,中等质量证据)、恶心(n=310,RR=2.59,95%CI:1.16~5.79,中等把握度证据)、腹痛、呕吐、腹绞痛[80]。后3个指标的证据体质量整体较低,GDG对受损程度的把握度不高。
其他因素:一项研究对百日咳暴露后大环内酯类药物预防治疗的成本效益做了分析,结果显示:阿奇霉素在各年龄组中均提供了最高的质量调整生命年(用于衡量医疗干预或治疗对个体生命质量的影响的指标),在儿童中产生的增量成本效益为16 963美元/质量调整生命年,成人为2 415美元/质量调整生命年;虽然暴露后预防的有效率(11%~87%)和住院费用(379~59 644美元)差别较大,但与百日咳暴露后不预防性治疗相比,预防性治疗有一定的效益成本,在接触者管理中具有重要意义,尤其是疾病暴发时[84]。从医疗支付角度考虑,阿奇霉素预防治疗对所有百日咳接触者是最佳策略。
GDG根据临床实践经验表明:百日咳暴露后预防治疗不会对卫生服务的公平性产生影响,且患者的价值偏好不存在重大差异(低把握度,专家经验)。因为百日咳是法定报告的传染性疾病,所以当医师建议使用抗菌药物时,绝大多数患者愿意配合预防或治疗,降低发病率,阻断疾病传播。干预措施的可接受度及可行性均良好(低把握度,专家经验)。但药物不良反应可能影响患者全程用药的依从性,1篇RCT研究报道预防用药的依从性,治疗组比安慰剂组的依从性差,与药物的不良反应有关[80]。
推荐理由:家庭成员暴露后预防的RCT研究证据显示:与对照组相比,干预组预防经细菌培养确诊的继发百日咳病例可能获益,但是干预组预防继发病例(包括经细菌培养确诊和临床诊断的病例)的获益不明显[79-80]。若从公共卫生的角度将成功预防感染作为临床终点来考虑,基于现有的证据,GDG对此效应的把握度极低。但是,结合以下事实:(1)我国报告的百日咳病例1岁以下患儿占52.4%,住院病例和ICU重症病例中1岁以下患儿分别占68.17%和95.72%[5];(2)大部分1岁以下婴儿病例未接种百日咳疫苗或未全程接种百日咳疫苗[52];(3)全程接种疫苗的婴幼儿百日咳病例症状较轻[28],未接种过百日咳疫苗的婴幼儿发生重症百日咳以及并发症的风险增加[29];(4)百日咳传播模式主要是家庭内传播,婴幼儿发病为主,成人是主要传染源[7,85],GDG高度推荐家庭内密切接触成员,尤其是与尚未接种或尚未全程接种DTaP疫苗的婴幼儿同住的家庭成员,暴露后应接受抗菌药物预防,以保护易感并发生重症百日咳的高风险婴幼儿。
虽然接种过疫苗的医务人员暴露后用阿奇霉素预防继发无症状感染的绝对风险仅降低6.7%[78],但是考虑到医疗机构和新生儿护理机构(月子中心)的传播风险大,以及百日咳对3月龄以下小婴儿的危害大,因此,GDG推荐在医疗机构和新生儿护理机构照护3月龄以下婴儿的、有密切接触史的工作人员应尽早接受抗菌药物预防治疗。同时,对于医疗机构和新生儿护理机构的有密切接触史的婴幼儿,若未接种或未全程接种百日咳疫苗,推荐暴露后药物预防治疗。早期国外的观察性研究显示,家庭成员无论是否干预治疗,继发百日咳的发病率不随年龄和免疫状态而变化[83];国内最新研究也显示,基于门诊咳嗽病例的PCR筛查策略,2岁及以上确诊百日咳病例占比可达47.0%,且95.7%全程接种过疫苗[52],因此,建议幼托机构的儿童和看护人员若有密切接触史,在暴露后接受抗菌药物预防治疗。GDG也考虑到聚集或暴发疫情的公共卫生影响,推荐疫情场所涉及的密切接触者应于暴露后接受抗菌药物的预防治疗,限制并减少继发病例的发生。
美国和英国的指南推荐所有年龄组的百日咳病例的家庭成员和密切接触者应接受暴露后抗菌药物预防,旨在降低继发百日咳的发病率,尤其要保护重症高风险的小婴儿[86-87]。考虑到国内百日咳病例实验室诊断尚未在各地区和各级医疗机构广泛开展,若基于临床诊断进行暴露后预防干预,会导致过度预防。因此,目前证据所提示的发病风险降低,在疾病散发状态时的获益低,但是在出现聚集性或者暴发病例、密切接触者为易感高风险人群、罹患重症高风险人群、重点场所人群(家庭内、医疗机构、护理机构、幼托机构等)时,预防干预的获益较好,越早接受化学药物预防效果越好。
证据总结:总共纳入3项研究。1项中国的RCT研究,比较2月龄和3月龄婴儿接种DTaP-IPV/Hib联合疫苗、2月龄婴儿接种DTaP-IPV/Hib联合疫苗和3月龄婴儿接种DTaP[89];1项日本的非RCT研究,比较2月龄和3月龄婴儿接种DTaP疫苗[90]。受试者均为足月健康儿,年龄范围50~98 d。基础免疫疫苗3剂次接种程序间隔1~2个月,18~20个月[91]或1年以后[90]接种第4剂加强针。
研究显示,初次接受免疫接种3剂次DTaP疫苗后,相比于3月龄组婴儿,2月龄组婴儿血清丝状血凝素(filamentous hemagglutinin,FHA)抗体(单位:Eu/ml)滴度升高(n=116,MD=7.1,95%CI:-7.78~21.98,低把握度证据)[90]。初次接受免疫接种DTaP-IPV/Hib疫苗后,相比于3月龄组,2月龄组婴儿FHA抗体降低10.7 Eu/ml(n=494,MD=-10.70,95%CI:-18.52~-2.88,高把握度证据);血清PT降低3.1 Eu/ml(n=494,MD=-3.10,95%CI:-10.32~4.12,中等把握度证据);但是两组婴儿血清PT抗体滴度升高≥4倍的发生比例(均为100%)和FHA抗体滴度升高≥4倍的发生比例(分别为98%和99.6%)差异无统计学意义[89]。相比于3月龄组,2月龄组婴儿全身不良反应和局部不良反应的发生风险降低,差异无统计学意义(全身不良反应:n=507,率差=-0.03,95%CI:-0.05~0,低把握度证据;局部不良反应:n=507,率差=-0.01,95%CI:-0.03~0.01,低把握度证据)[89]。
接种DTaP和DTaP-IPV/Hib疫苗的儿童,在初次免疫1年后、加强免疫前,相比于3月龄组,2月龄组婴儿FHA抗体滴度和PT抗体滴度降低(FHA抗体:n=605,MD=-2.26,95%CI:-4.17~-0.34,中等把握度证据;PT抗体滴度:n=488,MD=-1.30,95%CI:-2.82~0.22,中等把握度证据)[90-91]。加强免疫后,相比于3月龄组,2月龄组婴儿血清FHA抗体滴度降低8.54 Eu/ml(n=600,MD=-8.54,95%CI:-18.94~1.85,中等把握度证据)[89-90];同时,PT抗体可能减少3.7 Eu/ml(n=488,MD=-3.70,95%CI:-21.47~14.07,中等把握度证据)[89]。
加强免疫后,相比于3月龄组,2月龄组婴儿血清PT抗体滴度升高≥4倍的发生率和FHA抗体滴度升高≥4倍的发生率均可能增加(PT抗体滴度升高≥4倍:n=484,RR=1.02,95%CI:0.99~1.06,中等把握度证据;FHA抗体滴度升高≥4倍:n=484,RR=1.05,95%CI:0.99~1.13,中等把握度证据)[91]。全身不良反应两组差异无统计学意义(n=484,RR=0.98,95%CI:0.81~1.18,低把握度证据),局部不良反应两组差异无统计学意义(n=484,RR=0.97,95%CI:0.81~1.16,低把握度证据)[91]。严重全身不良反应两组差异无统计学意义(n=484,RR=0.70,95%CI:0.16~3.08,低把握度证据)[91]。严重注射部位反应两组差异无统计学意义(n=600,RR=1.10,95%CI:0.65~1.89,极低把握度证据)[90-91]。
此外,与3月龄接受初次免疫接种DTaP疫苗的婴儿相比,2月龄接种DTaP-IPV/Hib组血清PT抗体和FHA抗体滴度升高≥4倍的发生概率提高(PT抗体滴度升高≥4倍:n=494,RR=1.03,95%CI:1.00~1.05;FHA-IgG滴度升高≥4倍:n=494,RR=1.10,95%CI:1.05~1.16)[89]。同时,2月龄接种DTaP-IPV/Hib组婴儿的血清PT抗体滴度提高61 Eu/ml(n=494,MD=61,95%CI:55.35~66.65),FHA抗体滴度提高45.8 Eu/ml(n=494,MD=45.8,95%CI:37.89~53.71)[89]。上述均为低把握度证据,GDG对将含百日咳成分的疫苗从3月龄提早到2月龄进行初次免疫接种的获益存在不确定性。安全性方面,两组主动报告的注射部位的不良反应[发生率分别为7.7%(2/26)和0.4%(1/250),n=511,率差=0,95%CI:-0.01~0.02]、全身不良反应[发生率分别为0.4%(1/261)和2.0%(5/250),n=511,率差=-0.02,95%CI:-0.04~0]和严重不良反应[发生率分别为2.3%(6/261)和1.2%(3/250),n=511,率差=0.01,95%CI:-0.01~0.03]差异均无统计学意义[89]。基于疫苗接种针数,2月龄接种DTaP-IPV/Hib组婴儿接种部位泛红、肿胀的发生频次高于3月龄接种DTaP组,两组其他不良反应分别为呕吐(发生率分别为23.8%和16.3%)、异常哭闹(发生率分别为21.0%和27.7%)[89]。上述均为极低把握度证据,GDG对安全性指标组间差异的判断尚需更多的研究证据。
其他因素:我国新生儿普遍缺乏百日咳保护性抗体,约有98%的产妇和96%的新生儿缺乏百日咳保护性抗体,婴儿出生就面临感染风险[92-94]。根据我国2018至2021年百日咳报告病例的流行病学分析结果[5],0~2、3~5和6~11月龄的患儿分别占比26.44%、41.69%和31.87%;住院病例和ICU重症病例中1岁以下患儿分别占68.17%和95.72%;其中1岁以下住院患儿中,0~2、3~5和6~11月龄分别占32.10%、42.01%和25.89%;1岁以下ICU重症患儿中,<1、1、2、3~5和6~11月龄分别占1.12%、32.40%、24.58%、31.28%和10.62%。由此可见,婴儿特别是3月龄以下小月龄婴儿更易发生百日咳;并且年龄越小、无疫苗接种史、疫苗接种次数越不完全的婴儿,重症百日咳(住院和进入ICU)的发生风险越高。因此,首剂含百日咳成分疫苗接种年龄若提前至2月龄,能更早地保护儿童。从全球来看,90%以上的国家均于2月龄时接种首剂含百日咳成分疫苗的免疫程序[25,95]。
在等效的前提下,早启动疫苗接种可以为婴儿提供早期保护,还有可能减少发病或者发病后疾病的严重程度,减少对卫生资源的消耗[96]。来自澳大利亚的一项研究评价了DTaP疫苗接种延迟(出生15 d后接种疫苗为延迟)对百日咳疾病负担的影响,结果显示:2000至2012年在澳大利亚两个州出生的1 412 984名婴儿中,至少延迟接种1剂次DTaP疫苗的占42%。若所有延迟接种DTaP疫苗的婴儿按时接种了3剂次,则在日龄39~365 d的婴儿中,每10万名婴儿有85例(95%CI:61~109)百日咳病例是可以预防的。与按时接种组相比,延迟接种组发生百日咳的风险更高,每10万名婴儿百日咳病例增加110例(95%CI:95~125)。具体到不同剂次,第1剂、第2剂和第3剂DTaP延迟接种造成的每10万名生后39~365 d的婴儿百日咳患病人数分别增加132例(95%CI:105~160)、50例(95%CI:35~65)和19例(95%CI:9~29)[96]。该研究强有力地证实了提高婴儿DTaP疫苗接种的及时性,尤其是2月龄第1剂及时接种,可大大减少婴儿百日咳的疾病负担,从流行病学的角度体现了早接种的获益。
GDG根据经验判断,家长选择2月龄还是3月龄接种,不存在明显或重大的价值偏好差异,但是非免疫规划类多联疫苗仍属于自费疫苗,目前全国范围供应的可及性受限,因此,现阶段实施2月龄接种会涉及疫苗分配的公平性问题。
推荐理由:在对比2月龄和3月龄接种的利弊平衡方面,目前可获的研究证据中有一个来自中国的RCT研究和一个来自日本的非RCT研究提供了头对头的组间比较,结果显示:含百日咳成分联合疫苗在2月龄和3月龄接种时,其免疫原性和安全性效力相当[89-90]。同时,WHO指出,单剂百日咳疫苗对婴儿严重百日咳的保护率约为50%,应尽早、及时完成百日咳疫苗的接种,首剂应在6周龄、不晚于8周龄接种,6月龄前完成3剂基础免疫[95];其他国家的模型研究也提示2月龄婴儿及时接种第1剂DTaP疫苗可以大大减少婴儿百日咳的疾病负担[96]。从疫苗接种的安全性和免疫效力以及流行病学的角度考虑,上述研究证据均提示2月龄初次接种DTaP疫苗比3月龄初次接种可以使婴儿提早获益。
证据总结:纳入1项意大利非RCT研究[97],评价3 522名5~6岁已接种过3剂次DTaP疫苗的学龄前儿童接种第4剂DTaP(n=3 318)或DT疫苗(n=204)的免疫原性和安全性。另外有2项非RCT研究分别来自美国(n=317)[98]和德国(n=580)[99],观察4~6岁儿童接种第5剂DTaP疫苗加强免疫的免疫原性和安全性。
意大利研究中有588名儿童在接受DTaP加强免疫前后(接种后30 d)获得配对血清,PT抗体、FHA抗体和百日咳黏着素抗体平均滴度增加>10倍[97]。美国一项研究(n=317)中4~6岁儿童接种第5剂DTaP或DTwP疫苗加强针后,PT抗体、FHA抗体和百日咳黏着素抗体均增加[98]。德国一项研究(n=580)中4~6岁儿童接种第5剂疫苗后,97%的受种者血清PT抗体增加4倍,82%的受种者血清FHA抗体增加4倍[99]。这3项研究结果的效应类似,均提示加强接种的免疫原性良好。
意大利的非RCT研究结果显示:与接种DT疫苗相比,5~6岁儿童加强接种DTaP疫苗以下接种局部不良反应的发生风险略高,但GDG对此的把握度极低,包括:严重压痛(n=3 522,RR=3.40,95%CI:1.72~6.75);中度压痛(n=3 522,RR=1.24,95%CI:1.05~1.47);肿胀面积≥5 cm(n=3 522,RR=2.37,95%CI:1.45~3.88);肿胀面积<5 cm(n=3 522,RR=1.47,95%CI:1.21~1.79);泛红面积<5 cm(n=3 522,RR=1.54,95%CI:1.24~1.91);局部瘙痒(n=3 522,RR=4.15,95%CI:2.26~7.62)。两组间发热人数、局部不良反应以及情绪易怒方面差异无统计学意义[97]。以上均为极低把握度证据,因此,GDG不确定真实疗效与上述观测到的疗效的差异。
美国一项研究显示,4~6岁接种第5剂DTaP(n=317)或DTwP(n=10)疫苗后,发热和中、重度烦躁不常见,不良反应发生率低于接种第4剂的15~20月龄的幼儿,但是接种处红肿和疼痛的发生率增加[98]。德国一项研究(n=580)显示,4~6岁儿童接种DTaP后3 d内,发热(>38.0 ℃)、烦躁、困倦、厌食、呕吐分别占3.8%、19.7%、15.5%、7.3%、2.2%,接种部位出现任何程度的红、肿、痛分别占59.8%、61.4%、58.8%,仅有2.1%受种儿童疼痛需要临床关注[99]。
推荐理由:我国天津的血清流行病学研究结果显示:接种含aP疫苗的儿童,仅有20%在4岁时可以检测到血清PT抗体[45]。近期的研究显示6岁儿童血清PT-IgG抗体滴度降至最低(3.72 U/ml),估算的血清感染率从学龄期开始上升,9岁左右达到高峰,这些结果支持在学龄前引入百日咳疫苗加强剂次的必要性[100]。WHO也明确表示:对于使用aP疫苗的国家,保护效果在6岁前可能下降,因此,WHO建议在百日咳低发地区接种含aP疫苗,3剂次基础免疫和出生后第2年加强接种1剂次所提供的保护力可能不足以维持到6岁以后,推荐儿童入学时应给予1剂加强免疫[95]。荷兰一项研究显示实行学龄前儿童DTaP加强免疫后,5~9岁儿童百日咳住院率和发病率分别下降了32%和15%;同时,0~6月龄婴儿的发病率也呈下降趋势,每10万人的住院率下降了40%[101]。美国最近1项研究也显示学龄前儿童延迟强化免疫接种,5~9岁儿童的百日咳的发生风险增加4.6倍(95%CI:2.6~8.2)[102]。
已有的证据显示:4~6岁儿童接种第5剂DTaP疫苗的加强免疫后,PT抗体和FHA抗体滴度明显升高,真实世界数据也证实临床获益,而且学龄前儿童接种DTaP疫苗总体上是安全、可耐受的。基于我国儿童百日咳流行病学趋势和全球经验,我国应借鉴国际经验,推进实施4~6岁儿童DTaP疫苗的加强免疫。
文献回顾:1项为期4 d的RCT研究[103],纳入10家医院191例出生年龄56~60 d的早产婴儿(胎龄<37周),随机分为2月龄接种1剂DTaP疫苗组(n=93)和未接种对照组(n=98),观察接种后48 h内持续的心动过缓和持续呼吸暂停的发作情况和次数。
结果显示,接种组和对照组分别有16.1%和20.4%的婴儿发生至少1次延长的呼吸暂停发作,分别有58.1%和56.1%的婴儿发生1次心动过缓发作延长;组间发作频率的差异无统计学意义,接种组和对照组发生呼吸暂停发作延长的平均次数均为0.5次,延长心动过缓发作的平均次数分别为2.6和2.7次。研究支持美国儿科学会提出的建议:早产儿在实际出生后2月龄接种DTaP疫苗。
4项非RCT研究,比较健康状况良好的早产儿与足月儿接种百日咳疫苗的免疫原性,分别来自意大利[104-105]、德国[106]和西班牙[107]。早产儿胎龄为25~37周,出生体重为500~3 300 g;足月婴儿胎龄为38~42周,出生体重在2 500~4 410 g。疫苗接种程序以及组分与国内现行的方案有可比性和外推性。研究结果显示,足月儿3次基础免疫后4~6周的PT和FHA抗体平均几何滴度均高于早产儿(差异有统计学意义),但是两组间体液免疫反应阳性人数比例,以及PT抗体较免疫前升高4倍以上的人数比例差异无统计学意义。
一项最新的系统文献综述纳入了14项研究,研究对象为早产儿(<34周龄)或极低出生体重儿(出生体重<1 500 g)接种DTaP-IPV/Hib联合疫苗或无细胞百白破灭活乙型肝炎脊髓灰质炎和b型流感嗜血杆菌联合疫苗(Diphtheria,tetanus toxoid,acellular pertussis,hepatitis B,inactivated polio and haemophilus influenza type b vaccine,DTaP-HBV- IPV/Hib),其中的6项研究报告了接种疫苗后的血清抗体反应,8项研究报告了接种疫苗后的不良反应[108]。结果显示:早产儿对2种联合疫苗的抗体应答反应与足月儿基本相同,几乎所有不良反应均与足月儿相似;有几项研究观察到接种第1剂联合疫苗后,与足月儿相比,早产儿尤其是极低出生体重儿发生呼吸暂停、心率减慢或血氧水平降低的不良事件有所增加。因此,一些欧美专业学会建议:极低出生体重儿和早产儿在住院期间接种首剂含百日咳成分的联合疫苗48~72 h后监测生命体征。
推荐理由:早产儿因离开母体早,从母体得到的母传抗体少,更容易感染疾病。1项土耳其的队列研究显示,早产儿经胎盘传递获得的抗百日咳抗体及抗体水平低于足月儿,尤其是<32周的早产儿[109]。在住院百日咳患儿中,早产儿合并感染的发生率更高,出现并发症、需要呼吸支持的比率更高,在ICU的住院时间更长[103]。上述纳入的研究证据均提示接种疫苗对早产儿和足月儿的保护效力以及安全性相似。足月新生儿和早产儿接种第1剂百日咳疫苗预防住院的保护效果分别为95%(95%CI:93%~96%)和73%(95%CI:20%~91%),接种第2剂疫苗的保护效果分别为86%和99%[110]。因此,专家一致认为早产儿按实际出生月龄接种百日咳疫苗,可以更早地为早产儿提供保护,虽然早产儿接种1剂次的抗体应答率和水平以及保护效果低于足月儿,但是一系列研究证据表明:早产儿完成3剂次基础免疫和加强免疫后抗体保护水平和安全性相似。我国《国家免疫规划疫苗儿童免疫程序及说明(2021版)》[111]明确推荐:在医学评估稳定状态下,早产儿(胎龄<37周)和(或)低出生体重儿(出生体重<2 500 g)应按照出生后实际月龄接种疫苗。
文献回顾:关于百日咳成分疫苗相关性脑病总共纳入2项病例系列报道、1项病例对照研究[113-115]。加拿大评估了1993至2002年7例接种含百日咳成分疫苗后7 d内发生脑病的儿童,未发现与接种DTwP疫苗或DTaP疫苗有关[113]。丹麦分析报道1992至2012年收集的20例接种疫苗后并发脑病的病例,同样未发现与DTaP-IPV/Hib疫苗有关[114]。美国的病例对照研究分析了1988至1989年接种约36.8万剂次DTwP疫苗后通过主动监测发现的100例接种DTwP后7 d内发生急性脑病的儿童,相对于未接种儿童,接种组儿童调整后发生脑病的OR=3.6(95%CI:0.8~15.2),提示儿童接种DTwP疫苗后7 d内发生急性脑病的风险未增加[116]。
含百日咳成分的疫苗与惊厥发作的关联性共纳入2项队列研究。美国的研究采用风险区间队列方法比较433 654名儿童接种DTaP组和未接种组的惊厥发生率,采用自身对照的病例系列对惊厥发作患儿在接种3 d内和3 d后的惊厥发生率进行比较,结果显示:6周到23月龄儿童接种所有剂次的调整后,采用风险区间队列分析的惊厥发病率比率为0.87(95%CI:0.72~1.05),采用自身对照的队列分析的惊厥发病率比率为0.91(95%CI:0.75~1.10),均表明该年龄段儿童接种DTaP疫苗后发生惊厥的风险未增加[115]。丹麦的一项研究比较了378 834名接种DTaP-IPV/Hib疫苗的儿童,结果显示:与未接种组相比,接种3剂次DTaP-IPV/Hib疫苗后,0~7 d内患儿发生热性惊厥的风险未升高(RR=0.99,95%CI:0.86~1.15),接种DTaP-IPV/Hib疫苗随访7年发生癫痫的风险未升高(RR=1.01,95%CI:0.66~-1.56)[114]。美国的一项横断面研究报道的1996至1998年215例接种百日咳疫苗后发生低张力低反应发作的病例均为非致死性,呈良性自限性,症状无复发[117]。
我国开展了1项前瞻性观察性研究[118],评价了已确诊神经系统疾病患儿接种DTaP疫苗以及其他疫苗后对原发病的影响,结果显示:2 221例有任何神经系统疾病患儿的适龄DTaP/DT疫苗接种率仅占32.9%,并随访了347例推荐补种疫苗的遗传性脑病、免疫相关性脑病和癫痫患儿,其中249例患儿在1年内完成了包括DTaP疫苗在内的全部疫苗补种,主动监测未报告癫痫发作或原发性疾病加重。
推荐理由:百日咳疫苗相关性脑病是一种罕见的疫苗接种后不良事件,尚无证据支持儿童接种DTwP疫苗和发生急性脑病之间存在因果关系[119]。日本监测数据显示DTaP疫苗取代DTwP疫苗后,接种后7 d内因脑病死亡的发生率从1970至1974年的7.6例/每10万剂DTwP降至1989至2000年的0.5例/每10万剂DTaP,证明DTaP疫苗具有更好的安全性[120]。在全球逐步使用DTaP疫苗后,美国国家医学院重新审查了接种DTaP疫苗与多种神经系统不良事件的相关性,现有证据未能证实DTaP疫苗和神经系统疾病之间存在因果关系[121]。美国免疫实践咨询委员会推荐:既往接种含百日咳成分疫苗7 d内发生不明原因的脑病的患儿不应再接种DTaP疫苗[112]。
百日咳疫苗的安全性问题曾经引起公众广泛的担心和疫苗犹豫[122]。在疫苗接种实践中,神经系统疾病患儿在预防接种评估过程中同时面临家长和社区预防保健医师对疫苗安全性的担忧,导致该部分患儿经常发生迟种和漏种疫苗,尤其是DTaP疫苗[123]。基于已有的研究证据和监测数据,接种无细胞百日咳疫苗总体上是安全的,脑瘫[124]、发育迟缓[125]、有热性惊厥史[126]、控制良好的癫痫儿童[118]可以安全接种疫苗。我国《国家免疫规划疫苗儿童免疫程序及说明(2021版)》[111]在特殊健康状态的儿童接种基本原则中明确说明:单纯热性惊厥史、癫痫控制处于稳定期不是儿童疫苗接种的禁忌证。考虑到百日咳的疾病危害和保持易感个体和群体免疫远比接种疫苗后发生的不确定的罕见不良事件更重要,因此,GDG推荐神经系统疾病患儿在病情稳定状态下或者康复期可正常接种含百日咳成分的疫苗。
指南制订专家委员会名单
指南制订组联席主席:曾玫[复旦大学附属儿科医院感染传染科 国家儿童医学中心(上海)];邵祝军(中国疾病预防控制中心传染病预防控制所);张文宏(复旦大学附属华山医院感染科 国家传染病医学中心)
指南方法学家:夏君(宁波诺丁汉大学GRADE中心);姚晓梅(加拿大McMaster大学健康研究方法证据和影响系 复旦大学附属儿科医院临床实践指南制定和评价中心)
执笔者(按姓氏汉语拼音排序):蔡洁皓(复旦大学附属儿科医院感染传染科);陈明亮(复旦大学附属闵行医院检验科);冯天行(上海临床研究中心儿科);邵祝军(中国疾病预防控制中心传染病预防控制所);夏君(宁波诺丁汉大学GRADE中心);姚开虎[首都医科大学附属北京儿童医院 北京市儿科研究所感染与微生物研究室 国家儿童医学中心(北京)];曾玫[复旦大学附属儿科医院感染传染科 国家儿童医学中心(上海)]
指南制订核心专家(按姓氏汉语拼音排序):陈明亮(复旦大学附属闵行医院检验科);陈志海(首都医科大学附属北京地坛医院传染科);刘钢[首都医科大学附属北京儿童医院感染科 国家儿童医学中心(北京)];邵祝军(中国疾病预防控制中心传染病预防控制所);万朝敏(四川大学华西第二医院儿科);夏君(宁波诺丁汉大学GRADE中心);姚开虎[首都医科大学附属北京儿童医院北京市儿科研究所感染与微生物研究室 国家儿童医学中心(北京)];姚晓梅(加拿大McMaster大学健康研究方法证据和影响系 复旦大学附属儿科医院临床实践指南制定和评价中心);曾玫[复旦大学附属儿科医院感染传染科 国家儿童医学中心(上海)];张文宏(复旦大学附属华山医院感染科 国家传染病医学中心)
指南审阅专家(按姓氏汉语拼音排序):毕晶(首都医科大学附属北京儿童医院保定医院感染科);陈必全(安徽省儿童医院 复旦大学附属儿科医院安徽医院感染科);成怡冰(河南省儿童医院重症医学科);陈素清(福建医科大学附属第一医院儿科);陈益平(温州医科大学附属第二医院育英儿童医院儿童感染科);常海岭(复旦大学附属儿科医院感染传染科);邓慧玲(西安市中心医院儿科);邓莉(首都儿科研究所附属儿童医院感染科);华春珍(浙江大学医学院附属儿童医院感染科);黄丽素(浙江大学医学院附属儿童医院感染科);黄艳智(长春市儿童医院感染科);黄卓英(上海市疾病预防控制中心免疫规划所);李继安(济南市儿童医院感染科);林道炯(海南省妇女儿童医学中心 复旦大学附属儿科医院海南分院感染科);刘小乖(西安市儿童医院感染科);单庆文(广西医科大学第一附属医院儿科);孙晓冬(上海市疾病预防控制中心免疫规划所);田健美(苏州儿童医院感染科);王芳(河南省儿童医院感染科);王艳春(昆明市儿童医院感染科);徐爱强(山东省疾病预防控制中心免疫预防管理所);许红梅(重庆医科大学附属重庆儿童医院感染科);徐翼(广州市妇女儿童医疗中心感染性疾病科);张交生(深圳市儿童医院感染科);赵东赤(武汉大学中南医院儿科);朱春晖(江西省儿童医院感染科);朱庆雄(江西省妇幼保健院感染科);朱渝(四川大学华西第二医院儿科感染科)
学术秘书:常海岭(复旦大学附属儿科医院感染传染科);邱悦(复旦大学附属儿科医院感染传染科);冯天行(上海临床研究中心儿科)
所有作者声明不存在利益冲突
-
德国维润赛润百日咳原料清单
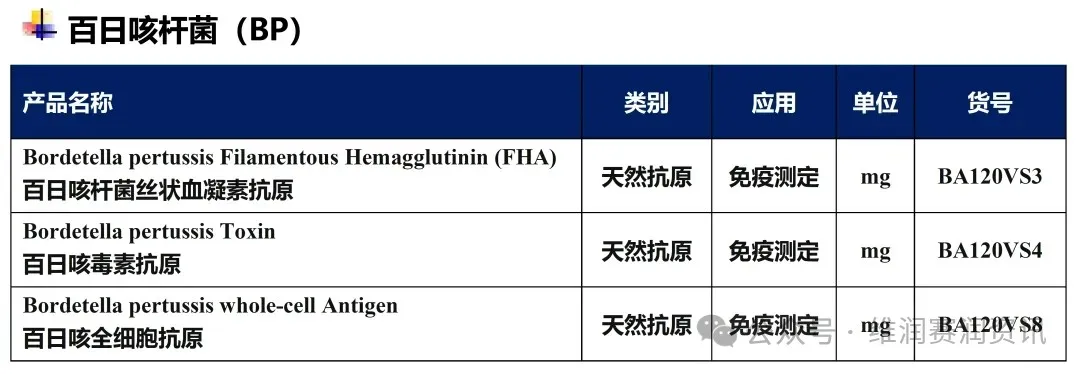

公司简介

德国维润赛润(Institut VirionSerion GmbH)成立于1978年,是国际知名的诊断产业原料生产商和供应商。公司的研发和生产基地位于德国维尔茨堡,已通过DIN EN ISO 13485质量体系认证,拥有三级生物安全实验室(P3实验室)。经过了40余年的发展,公司构建了丰富的生物原料产品线,主要包括天然抗原、重组抗原、人源化单克隆抗体和磁珠等。
助力我们的客户更加强大
永葆我们的价值无可替代





