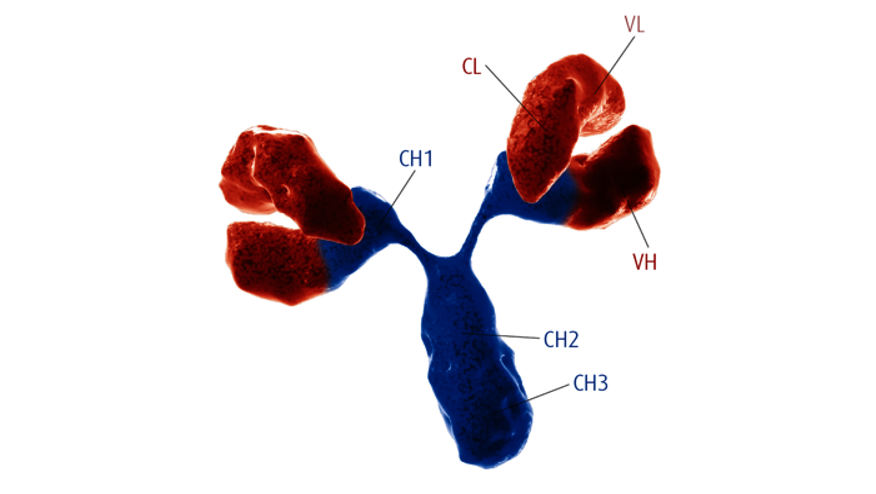
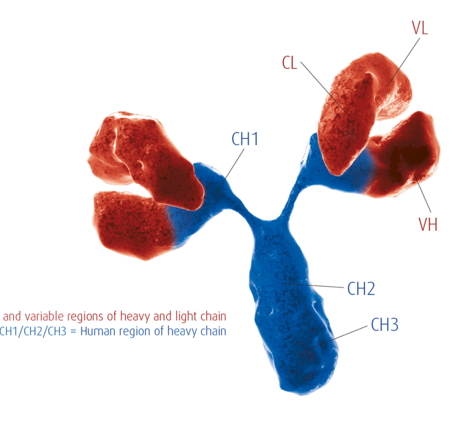
尽管发现阿尔茨海默病(Alzheimer′s disease,AD)已有100多年的历史,但是我们对于AD确切的发病机制还是知之甚少,也缺乏能改变疾病结局的治疗药物。关于AD的发病机制,学界存在着β淀粉样蛋白瀑布假说、炎性机制假说、氧化应激、线粒体功能障碍、细胞周期再进入等一系列假说。疱疹病毒感染假说已被提出约30余年,该假说认为:疱疹病毒如单纯疱疹病毒1型(herpes simplex virus 1,HSV1)等在中年时期进入大脑并保持潜伏状态,在免疫抑制、外周感染和炎症等条件下,疱疹病毒再活化,病毒活化的直接损伤和炎性反应最终导致AD的发生。尽管该假说能部分解释AD的发病机制,但一直处于边缘地位,不被学界认可。我们将围绕该假说的研究现状、进展,梳理该假说的支持证据与潜在争议。
一、疱疹病毒感染假说
(一)疱疹病毒存在于AD患者脑组织
一个有趣的现象是单纯疱疹病毒脑炎和AD影响的都是边缘系统,因此早在1982年,Ball就提出三叉神经节中的HSV-1再激活进入大脑,参与AD的病理生理。疱疹病毒感染学说的支持者坚定地认为疱疹病毒存在于人脑中。早在1991年,Jamieson等就用PCR的方法发现了HSV-1 DNA同时存在于AD患者和正常对照的脑组织样品中,提示AD患者和正常老年人均存在疱疹病毒的潜伏感染。随后,来自同一团队的Wozniak等又应用ELISA证实了大部分AD患者和正常对照的脑脊液中均有HSV1抗体的存在,提示脑组织中潜伏感染的疱疹病毒曾有再激活,但AD患者再激活的比例与对照相比并没有差异。此外,该团队还证实了人疱疹病毒6型(human herpesvirus 6,HHV6)、巨细胞病毒(cytomegalovirus,CMV)等其他疱疹病毒在AD患者脑组织样品中的存在,值得一提的是,AD患者脑组织中HHV6 DNA载量显著高于正常对照。
(二)疱疹病毒在AD发病中的作用
人群研究也提示HSV-1影响AD的发病和轻度认知障碍(mild cognitive impairment,MCI)向AD的转化。通常将抗HSV IgM作为HSV再活化的标志,抗HSV IgG作为既往感染的标志。Letenneur等在一项长达14年的前瞻性研究中发现,血清抗HSV IgM阳性的患者在随访中罹患AD的风险显著增加(HR=2.55,95%CI 1.38~4.72),而HSV IgG则与AD患病风险无关,提示HSV的再激活与AD患病风险的关联。但也有研究报道血清抗HSV IgG与黑质容积呈正相关,可能在AD早期病程中起保护作用。同样在遗忘型MCI患者中,未发生AD转化者其HSV-IgG抗体滴度显著升高,提示HSV IgG在MCI向AD转化中的保护作用。而多个研究小组也发现AD的大部分遗传易患基因[如载脂蛋白E(APOE)、三磷酸腺苷结合盒转运子7(ABCA7)、髓样细胞触发受体2(TREM2)等]在机体的抗病毒免疫反应中起重要作用。新近,Readhead等运用大数据分析的方法针对几个大样本的AD人群队列的研究发现:无论在正常老年或是AD患者的脑组织样品中均可发现多种常见病毒种群,如HSV、HHV、CMV等,但是AD患者脑组织中HHV-6A和HHV-7显著增加,且该变化与临床痴呆评分、神经病理等密切相关,进一步分析发现病毒基因组中的HHV-6对于AD风险基因和淀粉样前体蛋白(APP)代谢相关基因(如APBB2、APPBP2、BIN1、BACE1、CLU、PICALM、PSEN1)均具有调节作用。该研究为疱疹病毒感染在AD发病机制中的作用提供了新的依据,引起了学界对疱疹病毒感染学说的重新审视。
(三)疱疹病毒感染参与AD的病理生理机制
许多学者试图从机制上探讨疱疹病毒感染与AD病理生理之间的关联。运用原位PCR,Wozniak等进一步证实了HSV-1 DNA存在于大部分的β淀粉样蛋白(amyloid-β,Aβ)斑块中,提示HSV-1与Aβ病理存在着密切关联。体外实验中HSV-1感染引起神经细胞内Aβ1-42生成增加的同时,分泌至细胞外的Aβ1-42减少,在体实验中HSV-1感染后的小鼠脑组织切片中也可以看到Aβ1-42的聚积。后续的研究发现其机制可能与HSV对Aβ的生成和清除等环节的影响有关。HSV-1感染引起与Aβ生成密切相关的BACE1、nicastrin(γ分泌酶组分)表达增加,HSV-1还可通过PKR-eIF2-α通路活化BACE1,从而上调Aβ生成。此外,HSV-1病毒蛋白ICP34.5可以促进eIF2α去磷酸化和抑制自噬必需蛋白beclin1从而抑制自噬,并能调控自噬溶酶体通路的活性,使得吞噬Aβ的自噬小体并不能与溶酶体结合,从而导致Aβ降解障碍,导致Aβ清除减少。
HSV-1感染还与AD的另一重要病理特征——tau蛋白密切相关。HSV-1感染活化GSK-3β/PKA,从而引起tau蛋白在S202、T212、S214、S396/404等AD特征性位点的过度磷酸化,tau蛋白过度磷酸化并聚集在核周,导致HSV-1感染的细胞中轴突缩短,细胞骨架结构紊乱。此外,在体外培养神经元中,HSV-1感染还可激活caspase-3,在D421位点特异酶切tau蛋白,产生tauC3片段,而该片段与tau蛋白聚集密切相关。而阿昔洛韦、解螺旋酶-引物酶抑制剂等抗病毒药物、静脉注射免疫球蛋白、聚海藻糖等药物则能显著减少HSV-1感染细胞中的Aβ和tau水平。
(四)APOE与疱疹病毒感染相互作用
Itzhaki等的早期研究指出APOE4基因型的HSV-1阳性患者AD患病风险最高,提示APOE4基因型和HSV感染的相互作用影响AD发病。Burgos等运用APOE转基因小鼠进一步证实APOE基因对疱疹病毒神经感染的影响不在于急性期,而在于后续的潜伏感染状态的建立,病毒感染潜伏期APOE4小鼠脑内病毒负荷显著高于APOE3小鼠,而APOE敲除小鼠病毒负荷显著低于野生型小鼠。而Miller和Federoff基于APOE转基因小鼠的研究则认为APOE基因型影响的是病毒超早期的基因表达,从而影响病毒潜伏感染的建立,并不影响病毒负荷。
二、疱疹病毒感染假说的新证据
(一)积极干预疱疹病毒感染或可减少痴呆发病
既往的人群研究仅仅提示了疱疹病毒感染与AD发病的关联,而新近有3篇基于中国台湾健保数据库的临床研究文章则进一步提示积极干预疱疹病毒感染或可减少痴呆发病的风险,为该学说增加了新的证据。中国台湾健保数据库包含了中国台湾约99%的人群的医疗记录,3篇文章均利用该数据库研究了疱疹病毒感染与痴呆之间的关联。Tsai等选取了846例于2005年被诊断为眼部带状疱疹的患者(平均年龄62.2岁)和2 538名正常对照,并随访其在5年内的痴呆发病率。最终发现,眼部带状疱疹患者的痴呆发病率为4.16%,而正常对照组的发病率仅为1.65%,两者存在显著差异。在调整了患者的人口学特征和共病之后,眼部带状疱疹患者患痴呆的毛风险率为2.97,提示眼部带状疱疹患者的痴呆发病率较高。Chen等研究了39 205例在1997—2013年被诊断为带状疱疹病毒的患者(年龄54~90岁)。在平均长达6.2年的随访中,与39 205名对照(平均年龄63.5岁)相比,带状疱疹患者患AD的风险率为1.11,其风险系数相对较小的原因可能是由于眼部带状疱疹感染更容易进入大脑,而该大样本研究中则包含了全身性的带状疱疹感染。值得注意的是该研究同时报道,使用抗病毒药物的带状疱疹患者,其痴呆发病率下降至未治疗组的一半(调整HR=0.55,95% CI 0.40~0.77,P<0.000 1)。Tzeng等纳入了8 362例在2000年新确诊的50岁以上的HSV-1/2感染患者,并纳入了25 086名年龄性别相匹配的个体作为对照,随访其从2001—2010年的痴呆发病率,结果发现HSV感染组的痴呆发病率是对照组的2.56倍,主要发生于HSV-1感染患者中。令人兴奋的是,亚组分析提示在接受抗病毒治疗的个体中,有5.8%在后续的10年随访中发生了AD,而未接受抗病毒治疗的个体其痴呆发病率为28.33%,与未治疗的HSV感染者相比,接受抗病毒感染治疗的患者,其后期的痴呆发病率下降了约10倍(相对危险度:0.092, 95%CI0.079~0.108,P<0.001)。
(二)疱疹病毒感染诱导Aβ聚集机制
1.Aβ生成和聚集与病原微生物感染:
尽管既往研究指出HSV可引起Aβ的生成增多和沉积,但未阐明HSV感染与Aβ寡聚化、斑块形成等AD病理生理机制之间的关系,也未能阐明HSV感染引起Aβ生成增多的功能意义。HSV感染引起细胞内Aβ生成增多是病毒利用细胞满足自己生存?是病毒感染引起的细胞功能紊乱的结果还是细胞抵御病毒感染的机制?病毒感染多数能够抑制宿主细胞的蛋白合成,而HSV感染却引起Aβ的合成增加,是否由于Aβ对HSV病毒的生存有利?HSV的复制并不依赖于Aβ,因此HSV病毒利用Aβ满足自身生存的可能性并不大。Aβ瀑布假说是AD领域的主流学说,其核心在于认为纤丝状Aβ具有神经毒性,Aβ的聚集是AD病理生理的始作俑者。而近年来有的学者开始质疑Aβ在AD中的中心地位,提出Aβ聚集可能只是AD的结果或者是AD病理生理过程中的旁观者。早在2002年,Robinson和Bishop就提出了”生物絮凝剂假说” ,该假说认为在生理状态下,可溶性Aβ的功能在于结合细胞外的溶质,尤其是那些具有神经毒性的溶质(如金属离子等),进而将其沉淀入Aβ斑块中,从而有效地将这些神经毒性物质更好地递呈给脑内的吞噬细胞以便将他们从大脑内清除。确实,研究表明在外伤、炎症、缺血再灌注等各种应激条件下,Aβ生成也会迅速增加,而人群中也存在许多Aβ大量聚积而认知正常的个体,提示Aβ聚积与神经变性和认知损伤无必然的因果关系。Soscia等报道称Aβ和已知的抗微生物蛋白LL-37的抗微生物活性是相当的,AD患者脑组织样品较非AD脑组织样品抗微生物活性显著升高,而用抗Aβ抗体去除Aβ后的脑组织样品其抗微生物活性则降低,提示Aβ确实具有抗微生物作用。
2.HSV感染诱导Aβ聚集:
与生物絮凝剂假说异曲同工,Kumar等报道5XFAD(transgenic mice with five familial AD)转基因小鼠中细菌感染迅速引起Aβ斑块播散,将侵入的细菌包裹以抵抗细菌感染。新近来自同一小组的研究则报道了HSV感染引起Aβ播散的机制。与细菌感染类似,HSV病毒感染后,5XFAD小鼠较野生型小鼠生存率高,细胞实验发现Aβ寡聚体可以抑制HSV对宿主细胞的感染,提示Aβ可以抑制HSV感染,增加HSV感染小鼠的生存。进一步的机制研究发现类似的Aβ寡聚体通过其肝素结合结构域与HSV表面的糖蛋白结合,聚集成纤丝状Aβ,与病毒结合的Aβ寡聚体进一步寡聚化,从而将病毒包裹,限制病毒感染。在体实验中,在1月龄5XFAD小鼠(Aβ斑块尚未出现)脑内注射HSV后48 h迅速出现了Aβ斑块的聚集。该研究为HSV感染与Aβ病理生理的关联提供了新的解释,提示Aβ沉积可能是机体为应对病毒感染,将病毒感染局限化的一种生理反应,而该生理反应一旦失控,将导致Aβ斑块大量沉积,从而引起免疫炎症。当然该研究所采用的脑内注射HSV是否能模拟人体中HSV潜伏感染后的再活化有待进一步证实。
三、疱疹病毒感染假说的潜在争议
尽管疱疹病毒感染学说似乎能解释AD中Aβ沉积的机制,但其需要面对的一个最大的问题便是疱疹病毒感染的普遍性与AD发病的个体易患性之间的矛盾。单纯的疱疹病毒感染并不足以导致AD的发生,而疱疹病毒感染再活化的遗传易患性和个体对疱疹病毒感染诱导的Aβ沉积的免疫反应等恐怕才是导致AD病理损伤的直接机制。的确,如前文所述的APOE4便是调节机体免疫的重要分子,因此APOE4个体对于HSV潜伏感染再活化可能表现为迁延不愈的炎症,而APOE4和长期低级别炎性反应(C反应蛋白≥8 mg/L)可显著增加AD患病风险,这也许是APOE4和疱疹病毒相互作用影响AD发病的机制。其次,疱疹病毒感染假说需要解释的问题是AD病理的选择性损伤机制,AD中内嗅皮质和海马等区域是最早损伤的区域,而疱疹病毒感染是否也会选择性感染这些区域从而引起Aβ沉积并引起炎性损伤值得商榷。再次,疱疹病毒感染假说认为疱疹病毒潜伏感染的再活化是AD发病的重要机制,但在体中疱疹病毒感染的再激活究竟是AD的致病动因还是AD早期病理的结果还不得而知。
四、展望
尽管疱疹病毒感染假说还存在诸多争议,但其确实为我们提供了一种思考AD发病机制的新的范式,我们不应仅仅将Aβ和tau当作是AD的发病原因,也许它们只是其他导致AD发病因素的结果。后续的研究可围绕以下方面进一步探讨:(1)当前AD的风险基因如APOE、TREM2等是否影响疱疹病毒再活化诱导的Aβ沉积、炎性反应等从而影响AD发病?(2)抗病毒治疗是否能在中国台湾以外的更广泛的人群中切实减轻AD发病风险?(3)如果疱疹病毒感染假说是正确的,那么临床干预是基于疱疹病毒复制本身还是基于疱疹病毒潜伏感染再活化的遗传易患性?抑或是后续的炎性反应?临床干预疱疹病毒的时间点如何选择?这些问题的解决不仅有助于为疱疹病毒假说提供更加坚实的证据,也可为AD的临床干预开拓新的思路。
来源:中华医学网
如转载稿涉及版权等问题,请与我们联系。我们将迅速采取适当的措施。