新冠疫情发生以来,世界各国的经济发展均受到严重影响,据世界银行估算,全球经济今年将收缩5.2%。根据最新数据,美国第二季度GDP环比折合年率初值下降32.9%,创上世纪40年代以来最大降幅。而中国由于采取一系列强力预防控制措施,率先启动全面复工复产,经济上实现了由一季度负增长到二季度的“转正”。包括医疗器械行业在内的不少行业,在疫情初期受到了很大冲击,业务出现停滞甚至负增长。不过一些企业及时抓住机遇,通过生产销售防疫相关物资,反而实现了短期内的爆发性增长。尤其是在疫情中发挥关键作用的体外诊断试剂上市公司,通过提供新冠病毒的检测试剂盒,不仅取得业绩上的大幅增长,其股价也呈现出狂飙上涨,有些未上市公司也借机准备上市。下面是部分具有代表性的上市公司业绩数据简要汇总:<span

注:数据主要来自招股说明书、一季度报告、半年业绩预告,部分数据由于缺乏详细披露,采用了年均数据进行参考。股价上涨参考基准日期为2020年1月10日收盘价,即中国完成新冠病毒的全基因测序并向全球共享数据的时间。
从上表不难看出,部分企业在2019年同期本已经出现营收或净利润的负增长态势,但在疫情期间,由于新冠试剂销量的强劲增长,2020年一季度和上半年的营收或净利润实现了多倍增长。其中以PCR试剂为主的圣湘生物预计上半年净利润同比增长88倍,相比而言,以POCT抗体试剂为主的万孚生物虽在2020年第一季度净利润仅增长35%,但在上半年至少也能实现100%的增长。这与前期重视PCR检测后期重视补充抗体检测手段的新冠防治策略有关。
此外,国内针对新冠试剂采用集中采购方式,本就饱和的市场中竞争更加激烈,导致试剂的最终销售价格不断走低。相比而言,境外地区对试剂价格并不敏感。所以很多公司在布局海外市场。随着海外疫情不断反复,以上企业的出口业务占比将逐渐提升。
说到海外市场,以上企业因为较早在国内取得了NMPA批准的注册证,在出口方面并未收到相关法规变化的影响,但其他一些专营出口生意的公司,在年初受的影响就比较大了。原国家食品药品监督管理总局(现称国家药品监督管理局)曾于2015年6月1日发布过关于医疗器械产品出口的相关规定通知(18号通知),按照通知内容,原则上出口产品要先取得国内注册证和生产许可证,再申请开具出口销售证明方能出口。但实践中,部分企业专营出口业务,并没有申请在国内注册的动力,法律法规并未就此情况有特别详细阐述,因此这些企业仍按惯例,不在国内注册,只取得国外认证后便继续出口业务。这种情况持续到国外用户因产品质量要求某些中国企业退货等风波的出现,于是国家有关部门开始加强监管。2020年3月31日,由商务部、海关总署和国家药品监督管理局发布联合公告(5号公告),其中要求出口产品要取得国内产品注册证。很快,在5号公告基础上,政策得到进一步完善和优化,由商务部、海关总署和国家市场监督管理总局联合发布了12号公告,对出口产品按照中国质量标准和国外质量标准两套体系管理执行。按照新的12号公告,只要出口产品符合进口地区要求,同时企业进入中国医药保健品进出口商会的清单中,便可将试剂等防疫物资出口。
至此,能否出口,出口的具体标准在哪里,这些围绕企业出口业务的政策问题得以厘清,符合条件的企业终于可以安心出海。截至7月21日,清单中涉及新冠病毒检测试剂的出口厂家共计423家,远远多于取得国内医疗器械注册证的厂家数量。
而近日,挪威质量改进实验室检查组织(Noklus)发布了《17种新冠抗体试剂评价报告》,评估了挪威市场上的17种新冠抗体试剂;此次评估从敏感性、特异性、用户友好性(操作简单、结果易读)三个方面进行了评估,敏感性超过90%、特异性超过97%评为“可接受”。上述的三个方便如有一项是“不被接受的”,给出的整体评价是“不被接受的”。总体评价较好的产品占17.6%;可接受的占47%,不可接受的占53%。这份报告中,Noklus对新冠抗体检测试剂的产品提出了一定的要求, POCT产品需要用户友好性的同时,更需要准确性;这也是对53%的IVD企业提出了更高的要求。
与此同时,全国卫生产业企业管理协会副会长、医学检验产业分会会长宋海波教授在近期的研讨会中强调:一个试剂的好坏,使用体验感是否舒适,是对产品的最高肯定和研判。好试剂的使用体验感,一定建立在以好的上游原材料为支撑的基础之上。每一款好产品,都需要优质的上游原材料支持。因此,选择一个好的原料、把控上游原材料的质量,显得极为重要。在重视上游原材料的同时,一定要认真的筛选符合企业发展战略、产品结构、产品质量要求的优质上游原材料。只有这样,才能生产出好的产品,确保产品的质量。
德国维润赛润研发有限公司(Institut VirionSerion GmbH)成立于1978年,是一家拥有三级生物安全实验室(P3实验室)、DIN EN ISO13485 质量认证体系、CE 认证体系的生物原料和体外诊断试剂生产商,生产天然抗原、重组抗原、人源化单克隆抗体、磁珠、牛血清白蛋白等生物原料,是国际上重要的生物制品原材料供应商之一。经过四十多年发展,VirionSerion已成为一家国际知名的,受尊敬的IVD制造商。维润赛润生物技术(深圳)有限公司成立于2015年,是Institut VirionSerion GmbH在中国设立的控股子公司。维润赛润(深圳)致力于为国内的IVD生产企业、研发机构和相关产品的使用单位提供高品质的抗原、抗体、磁珠等生物原材料以及优质的传染病抗体检测试剂盒,全面负责VirionSerion产品在亚太地区的市场销售、技术服务和商务合作。
SERION SARS-CoV-2抗原保持一贯的高品质,产品符合DIN EN ISO 13485质量体系,在P3实验室反复临床验证及优化,是生产优质诊断试剂的强大保障!

★质量体系
DINEN ISO 13485;欧盟指令98/79/EC。
★技术优势
三级生物安全实验室(P3实验室)临床样本反复验证;真核表达(昆虫细胞)。
★应用范围
适用于CLIA、LF、ELISA等免疫检测平台。
★产能保证
工业化量产;稳定供应。
基于试剂产品开发特点,为了满足试剂用户的需求,SERION充分发挥拥有P3实验室的技术优势。SERION SARS-CoV-2抗原在实验室开发阶段就使用大量临床样本进行反复验证、持续优化。
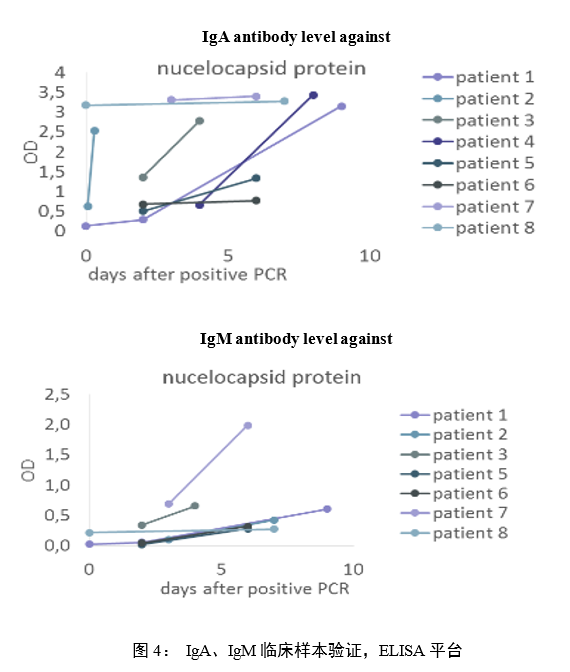
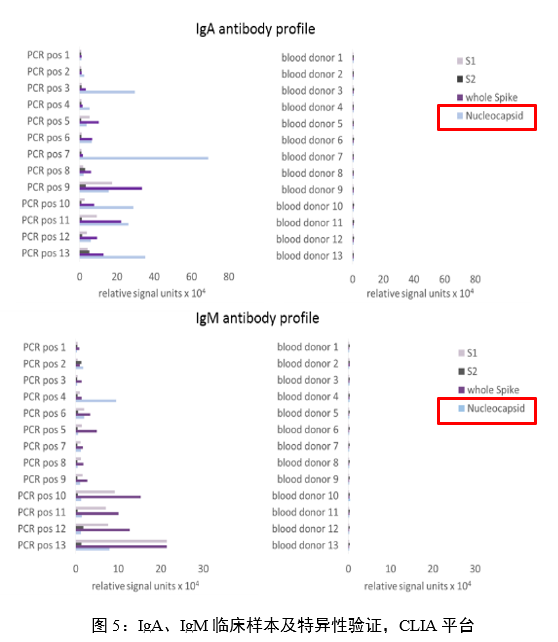
SERION SARS-CoV-2核蛋白在ELISA和CLIA平台的临床验证结果如图4、图5。
在发病早期,采集PCR阳性病例的双份血液样本(不同时间),用SERION SARS-CoV-2核蛋白在ELISA平台上分别检测IgA和IgM抗体。结果表明,SERION SARS-CoV-2 核蛋白能准确检出抗体水平变化。
采集PCR阳性病例的血液样本,用SERION SARS-CoV-2 核蛋白在CLIA平台上分别检测IgA和IgM抗体,同时检测阴性样本。结果表明,SERION SARS-CoV-2 核蛋白能准确检测阳性样本和阴性样本。
SERION SARS-CoV-2抗原为新航海新时代赋能!
参考文献:
【1】《挪威发布《17种新冠抗体试剂评价报告》,5个中国产品“不可接受”?》
【2】《宋海波:体外诊断上游原材料筛选的重要性》
【3】《精雕细琢,工匠精神 ——维润赛润隆重推出“经临床验证”的SARS-CoV-2抗原》
编辑:Steven | 校对:Harris | 责编:Hillson