
TORCH一词最早于1971年由埃默里大学免疫学家Andre Nahmia提出,包含一组可导致先天性宫内感染的病原体,感染此类病原体后可通过胎盘或产道或者新生儿,可能导致流产、早产、畸胎、死胎、宫内发育迟缓、新生儿多器官损害等不良预后。
T 代表弓形虫 :Toxoplasma gondii,Toxo;
R 代表风疹病毒 :Rubella virus,RV;
C 代表巨细胞病毒 :Cytomegalovirus,CMV;
H 代表单纯疱疹病毒:Herpes simplex virus,HSV;
O 代表“others” :varicella zoster virus(水痘-带状疱疹病毒)、 parvovirus B19(细小病毒B19)、Epstein‑Barr virus(EB病毒)、syphilis(梅毒)、Coxsackievirus(柯萨奇病毒)、Zika virus(寨卡病毒)等。
其中弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒被誉为“传统TORCH”,近年来Other中的病原体不仅频发引起宫内感染及新生儿不良预后,且经流行病学调查发现此类病原体的血清阳性率占比较高,国际上已将更多的病原体纳入TORCH筛查检测,加强孕前、产前TORCH感染监测。不仅如此,多个国家和地区将孕前、孕期筛查涉及的病原体纳入围产保健的重要项目。
病原体可从母体血液通过胎盘绒毛进行垂直传播,也可以经过顶叶蜕膜或子宫颈通过羊膜囊传播感染等多种途径感染胎儿,在孕早期,孕中期、孕晚期等的感染途径如下:
孕早期(0-13周):病原体感染易影响胎盘发育,导致流产或早产;
孕中期(14-26周):影响正常胎盘和胎儿的发育;
孕晚期(27-40周)及围产期:病原体感染将导致新生儿死亡或终生感染。
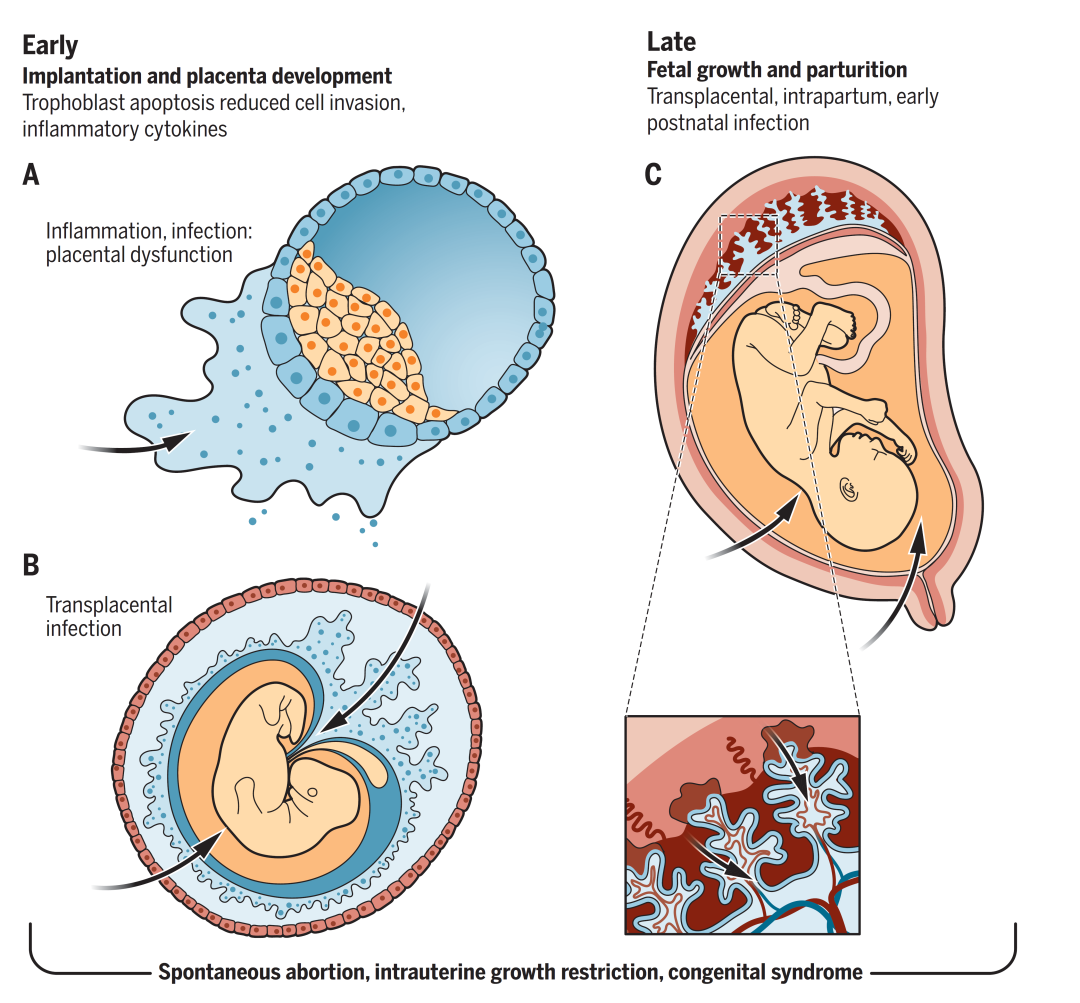
图1:TORCH病原体的感染途径
检测流程与风险判别
目前,TORCH临床实验室检测的首选检测方法是血清学检测,其原理为免疫应答的抗原抗体特异性结合;在机体的免疫应答过程中,主要是由获得性免疫特异性实现的,即免疫应答的特异性是指抗原的特异性,阐述TORCH相关病原体的免疫应答过程,科学合理的选择合适的抗原,可指导提高血清学检测的准确性;梳理病原体的检测流程及风险判别,可辅助临床决策。
1. 弓形虫
1) 免疫应答过程
目前诊断弓形虫感染的血清型指标为IgM和IgG;根据弓形虫感染引起的免疫应答过程可知,不论是急性感染还是无临床症状感染,弓形虫IgM识别的抗原组分包括:20kDa、23kDa、25kDa、28kDa、30kDa、32kDa、35kDa、38kDa、45kDa、55kDa等多组抗原;在感染弓形虫后的4周、6周、9周及45周过程中,与机体IgG抗体反应的弓形虫抗原也为多种抗原,分子量从6kDa-150kDa不等;据研究表明,人体内抗弓形虫IgG抗体至少识别17种以上弓形虫的抗原成分,其大部分抗原来自弓形虫滋养体的内部结构成分;由此可知,弓形虫感染引起机体IgM、IgG抗体免疫应答均为多重抗原成分,见图2。
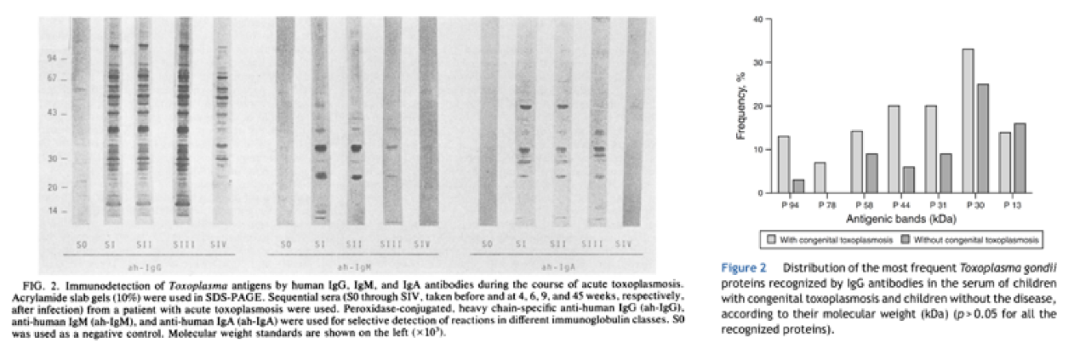
2) 弓形虫检测流程与风险判别
弓形虫感染的孕期检测流程与风险判别请见下图3
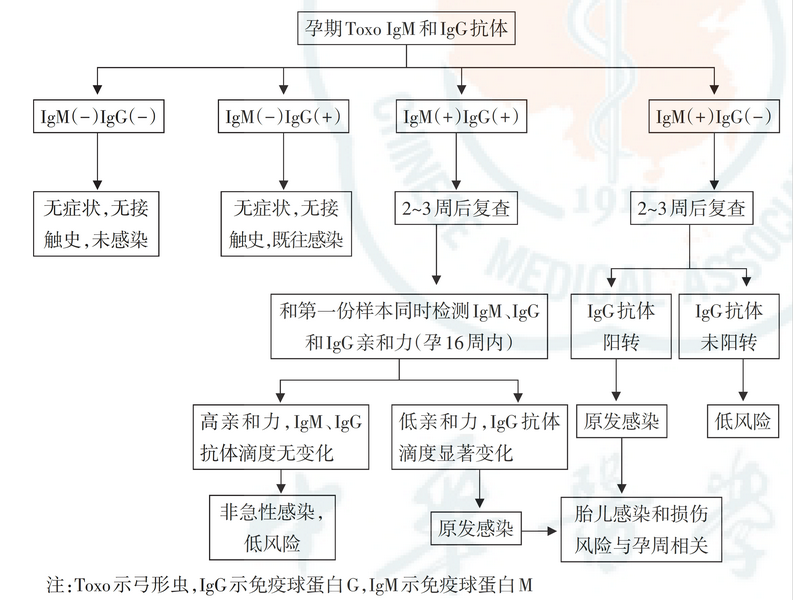
图3:弓形虫感染孕期检测流程与风险判别
2. 巨细胞病毒
1) 免疫应答过程
血清学检测不仅是目前CMV感染筛查的首选方法,对CMV感染风险判断具有重要价值。在CMV感染的不同阶段,其引起宿主免疫应答的抗原表位略有不同。当机体初次感染CMV后,发现不同患者之间所引起免疫应答的抗原表位存在差别;在感染初期(0.5-2周内),少部分人群中主要以IE1、p52抗原表位与IgM产生特异性反应;在初次感染后3-4周后,更多人群以IE1、IE2、p52、pp65等多个抗原表位与IgM产生特异性免疫应答。在检测IgG的过程中发现,IE1、IE2、p52、pp65等多个抗原表位与IgG产生特异性免疫应答,随着感染时间的增加,多个抗原表位刺激产生的免疫应答更稳定;由此可见,无论在原发感染还是继发感染阶段,均为多重抗原表位引起机体产生IgM、IgG免疫应答反应,这与CMV感染宿主后完成其基因组的转录表达相一致。见图4。

图4:CMV不同阶段感染患者体内IgG、IgM、IgA的免疫应答情况
2) 巨细胞病毒检测流程与风险判别
巨细胞病毒感染的孕期检测流程与风险判别请见下图5:

图5:孕期巨细胞病毒感染检测流程与风险判别
3. 风疹病毒
1) 免疫应答过程
皮疹发作后的3-6天是检测风疹IgM抗体是急性风疹的首选方法,持续1-3个月,随后下降直至消失;IgG抗体在感染后的2-3周可检测到,随着感染的进展发现,不同结构蛋白引起的免疫反应不尽相同,外膜糖蛋白E1在刺激机体后引起的免疫反应随总的IgG抗体保持一致,外膜糖蛋白E2也将在短期内升高,与总IgG抗体一致;核衣壳蛋白C在刺激机体后在短期内下降消失,表明外膜糖蛋白是引起机体免疫反应的主要抗原表位;在原发性风疹病毒感染的体液免疫反应的研究中,外膜糖蛋白是引起机体产生IgM、IgG抗体的主要抗原表位(见图6)。尤其在IgM的血清转化过程中,主要以E1、E2为主,未见核衣壳蛋白C的表达;由此可知,在风疹病毒诊断IgG的抗原选择以外膜蛋白(E1-E2)为主,而风疹病毒棘突蛋白(E1-E2)是风疹病毒外膜糖蛋白E1通过链内和链间的二硫键与外膜糖蛋白E2形成稳定的E1-E2异二聚体;E1-E2异二聚体具有E1、E2单体的优势特点及其形成的空间构象抗原位点,E1-E2异二聚体在特异性方面完胜E1单体和E2单体。
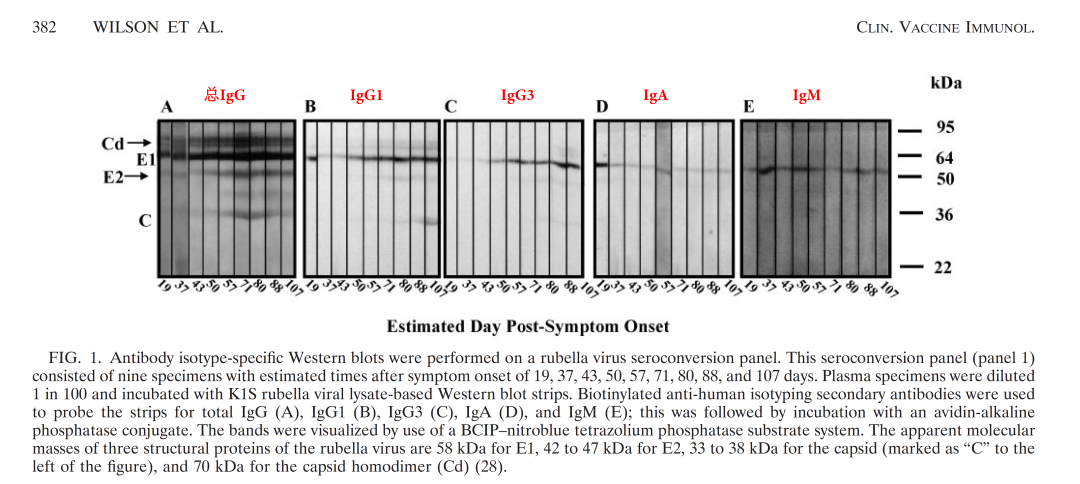
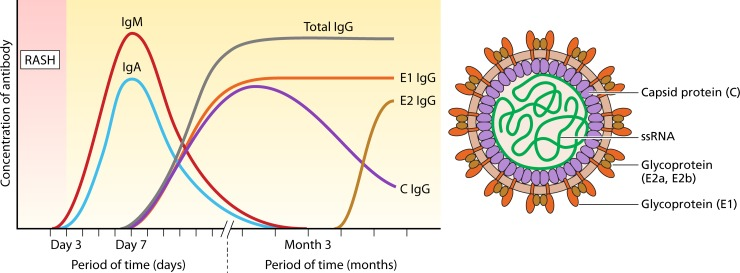
图6:风疹病毒感染后的免疫应答随时间变化
2) 检测流程与风险判别
风疹病毒感染的孕期检测流程与风险判别请见下图7:
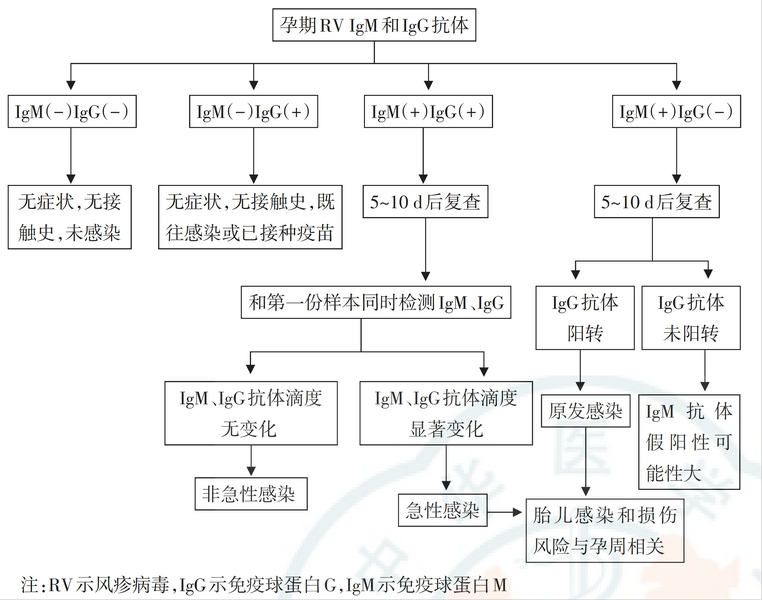
图7:风疹病毒感染孕期检测流程与风险判别
4. 单纯疱疹病毒
1) 免疫应答过程
HSV的基因组可编码约75种不同的结构蛋白和非结构蛋白,在不同的时间点合成表达的蛋白质不同。首先,早期基因转录合成病毒早期蛋白及早期多肽;然后通过合成的早期蛋白及早期多肽激活中晚期基因转录表达,合成中晚期蛋白(主要有糖蛋白gB,gC,gD,gE,gG,gH,gI ,gL,gM,gN等),以完成病毒的整个复制(见图8)。不同时期转录生成的蛋白,在病毒入侵宿主过程中发挥不同作用,因此,引起的免疫应答也存在差别。
在HSV急性感染期,IgM主要识别结构蛋白、病毒早期蛋白、早期多肽;这与HSV基因组的转录表达过程是一致的,证明在HSV感染过程中引起IgM产生免疫应答的主要抗原为早期蛋白、早期多肽(即早期蛋白)、结构蛋白等;
HSV-1和HSV-2之间存在着许多生物学相似和大部分相同的免疫原性序列;研究表明,对于HSV免疫原性包膜糖蛋白,除糖蛋白G之外的所有糖蛋白均包含引起交叉反应性B细胞和T细胞反应的免疫原性区域。
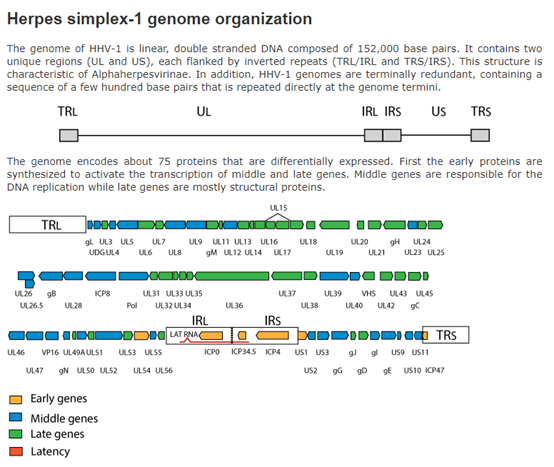
图8:HSV-1的基因组转录(图片来源: ViralZone)
2) 检测流程与风险判别
单纯疱疹病毒感染的孕期检测流程与风险判别请见下图9
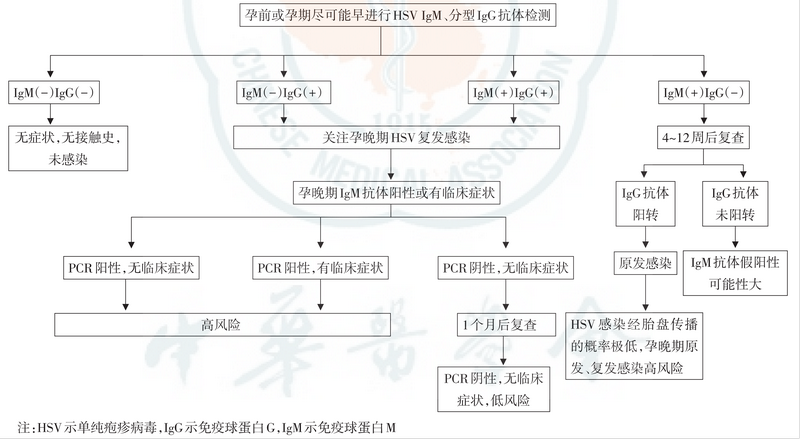
5. 细小病毒B19
1) 免疫应答过程
血清学抗体检测是目前细小病毒B19感染的临床辅助诊断和流行病学调查研究的主要方法;IgM可在细小病毒B19感染后的7-12天可检测到,IgG可在15天后可检测到;而引起机体产生免疫应答的主要抗原有衣壳蛋白(VP1约占5%、VP2约占95%)、非结构蛋白NS1;目前以衣壳蛋白VP2检测IgM、IgG抗体最可靠,也有增加NS1和VP1抗原进行补充;VP2在体内或体外均可自组装成病毒样颗粒VP2-VLP,在真核表达系统(如杆状病毒表达)可表达出与天然抗原一致抗原性和构象表位,使检测结果更准确;而原核表达的线性表位在操作过程中易变性,检测过程中会出现假阴性,因此,VP2-VLP是当前最适用于细小病毒B19抗体检测的抗原,也可在此基础上根据需求增加VP1或NS1抗原进行补充
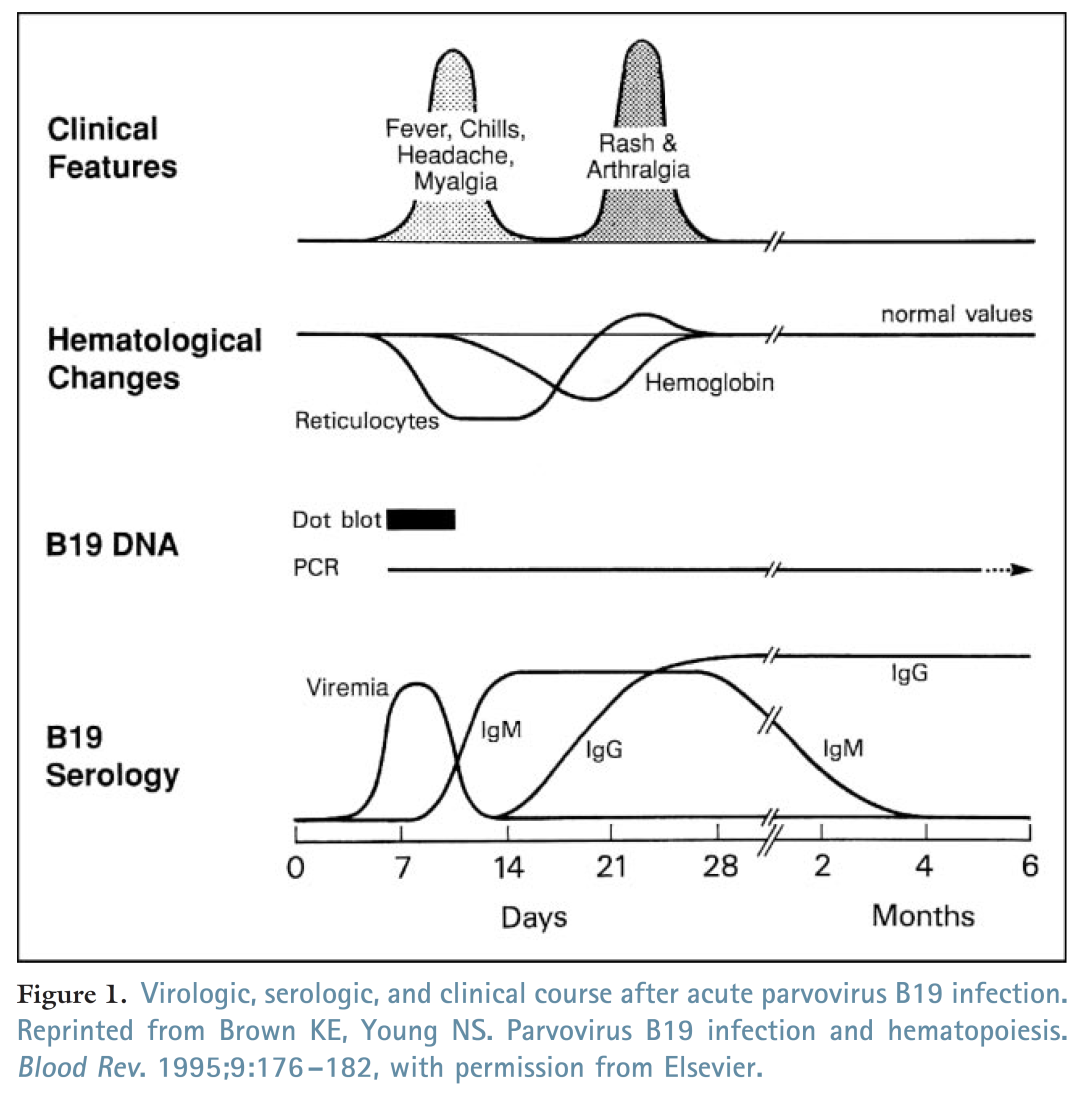

图10:细小病毒B19 感染的血清学、病毒学及临床特征
2) 检测流程与风险判别
细小病毒B19感染的孕期检测流程与风险判别请见下图11

6. 水痘-带状疱疹病毒
1) 免疫应答过程
血清学检测对于水痘及带状疱疹的感染诊断、免疫状态检测、易感人群的确定及评价免疫效果均具有重要意义;对于不同类型抗体的检测其抗原选择是不同的。
水痘患者参与VZV-IgM的蛋白反应区域为32-255kDa,在32kDa-35kDa(非糖蛋白结构区)反应性最强,78-108kDa蛋白区域反应性相对较弱。带状疱疹患者参与VZV-IgM的蛋白反应区域为31-170kDa,与水痘患者相似,在32kDa-35kDa(非糖蛋白结构区)反应性最强,部分患者在32kDa-35kDa区域蛋白的峰值稍晚于78kDa-108kDa区域蛋白。由此可见,参与VZV-IgM的蛋白反应区域主要为32kDa-35kDa和78kDa-108kDa,也就是说检测VZV-IgM抗体的最佳抗原至少需包含两大蛋白反应区域,目前全细胞抗原为最佳抗原选择。
水痘患者参与VZV-IgG抗体谱反应区蛋白主要为78kDa-114kDa(糖蛋白区域),带状疱疹患者参与VZV-IgG抗体最主要的抗体谱反应区蛋白为78kDa-108kDa(糖蛋白区域);与引起水痘患者VZV-IgG的抗体谱相比,引起带状疱疹的VZV-IgG抗体谱的反应性更强。由此可见,参与VZV-IgG抗体谱反应区蛋白的主要为水痘-带状疱疹病毒的糖蛋白。
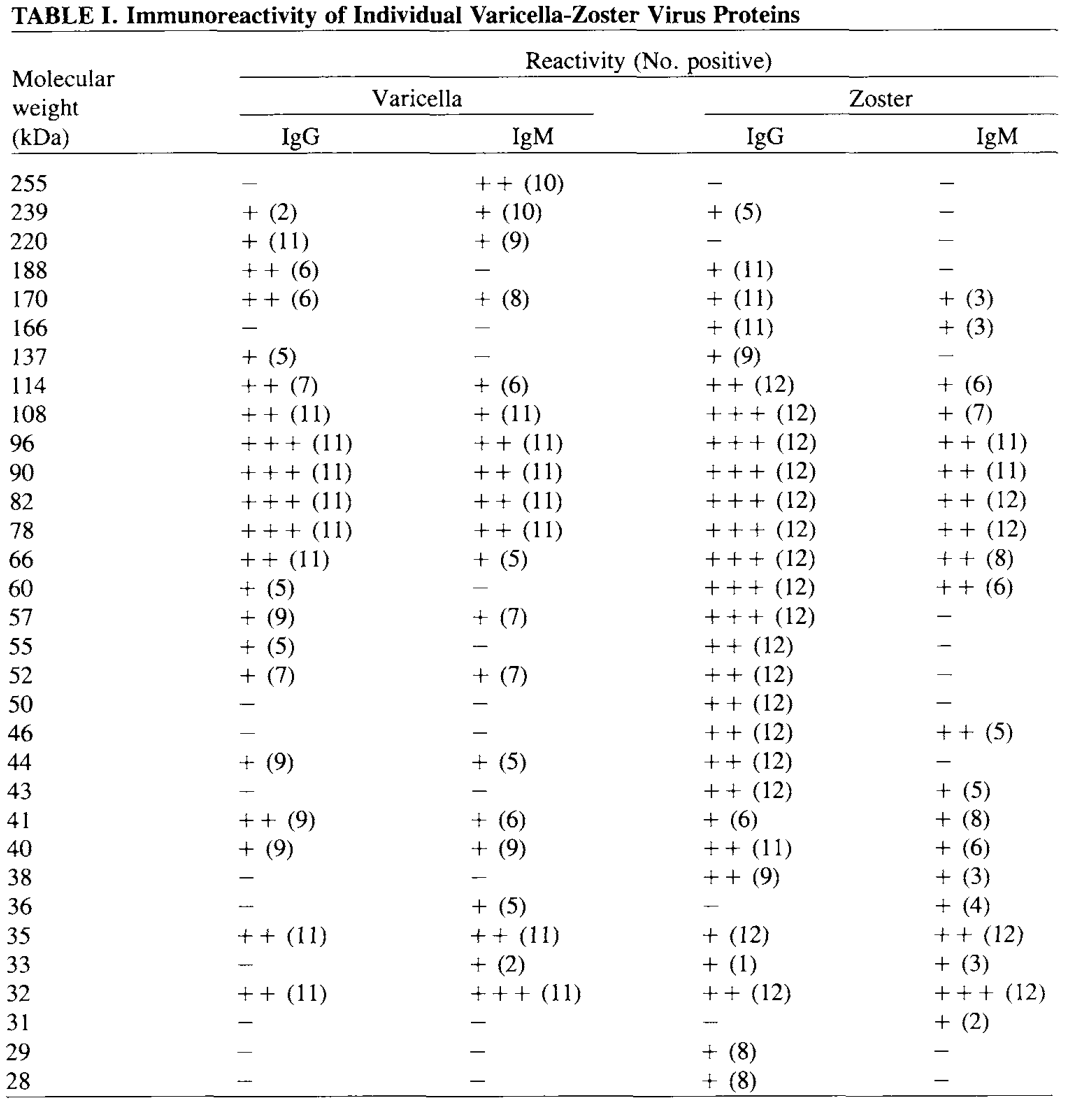
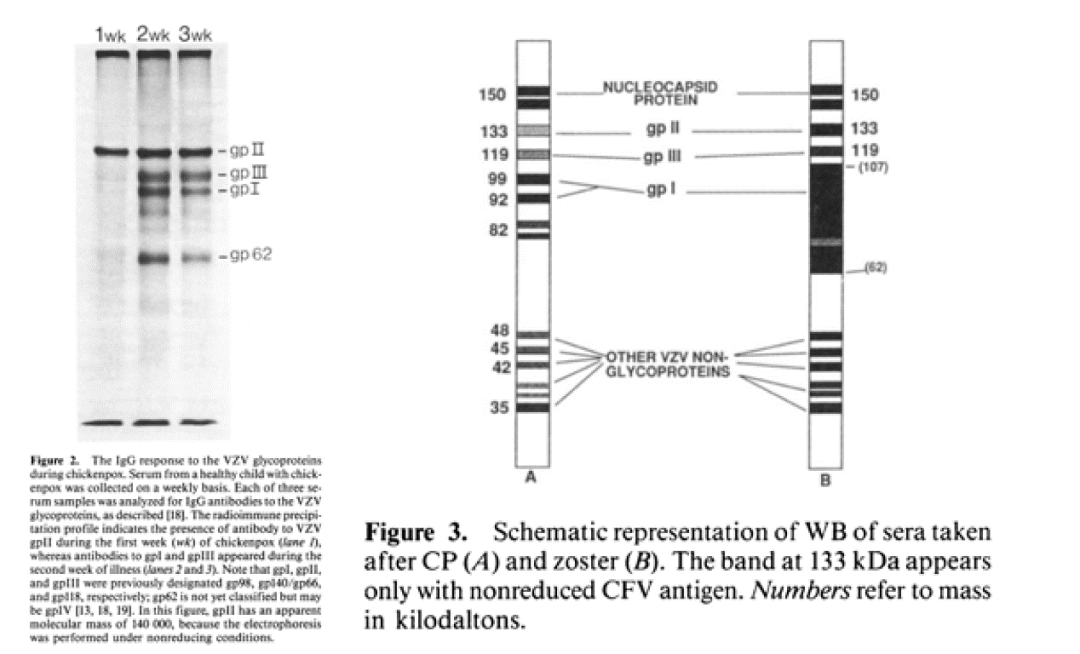
图12:水痘-带状疱疹病毒感染阶段患者体内IgG、IgM、IgA的免疫应答情况
2) 检测流程与诊疗过程
水痘-带状疱疹病毒感染的孕期检测流程与诊疗过程请见下图13
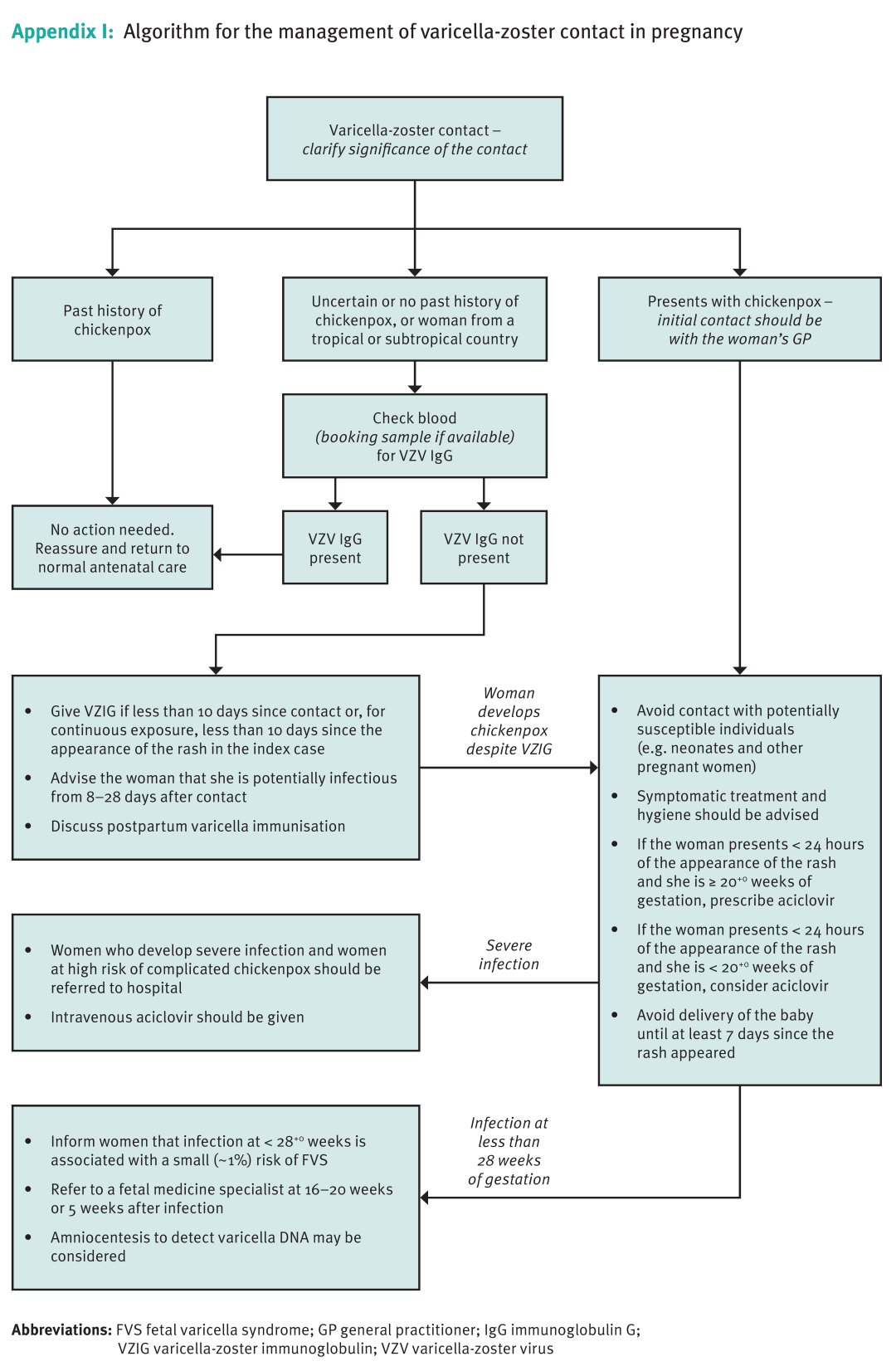
图13:水痘-带状疱疹病毒感染孕期检测流程(来源:英国皇家妇产科医师学院RCOG)
保障TORCH血清学抗体检测结果的准确、稳定和可靠的主要决定因素在于原料的选取;根据TORCH的免疫应答过程、检测流程与风险判别对TORCH项目的抗原选择进行梳理汇总如下:

随着中国人口老龄化严重和国家三胎生育政策的出台,意味着将有更多的高危妊娠和更高的出生缺陷,TORCH 感染是产前、围产期和产后发病率和死亡率增加的主要原因,加强孕前、产前TORCH感染监测预防出生缺陷至关重要;科学合理地采用抗原选择策略能有效保障抗体检测结果的准确、稳定和可靠性,并有助于避免相关不良妊娠结局的发生。
注:关于文章的任何疑问,请咨询作者邮箱:hillson.zhu@virion-serion.net
产品咨询 SERION原料事业部: 18818686988 0755-89381139
编辑:Steven | 校对:Harris | 责编:Hillson
干货分享
助力我们的客户更加强大 永葆我们的价值无可替代





免责声明:本文仅代表作者本人观点,不代表维润赛润资讯的观点和立场。文章图片均来源于网络,如有侵权,请联系作者删除,欢迎联系小编。




