2020年全球体外诊断(IVD)市场规模747亿美元,上游核心原料约占整体市场的10%,其中生物微球等载体系统约占核心原料的25%,2020年全球IVD生物微球市场空间约为18.675亿美元,国内约为17.825亿元。其中免疫诊断市场中的国产化学发光试剂厂家对生物磁珠原料的需求最大,主要是进口为主,少量是自产或者国产。小而美的生物磁珠深刻影响IVD市场尤其免疫诊断市场的走向和发展规模。
磁珠可以与药物、蛋白质、酶、抗体或核酸结合,最开始的磁珠被广泛应用于多种体内实验,比如药物传递、磁共振成像(MRI)造影剂和热疗等。但是因为磁珠材料本身的生物相容性和细胞毒性等等因素,限制了磁珠在体内实验的应用,反而体外实验应用得到更广泛的发展,本文主要综述磁珠在体外实验的用途,尤其应用在临床市场上的各种体外诊断技术,以及学术科研领域生物分子的纯化应用,比如细胞和外泌体分离、核酸提取、生物药物的靶点鉴定及代谢性质研究、蛋白纯化与免疫层析等等。
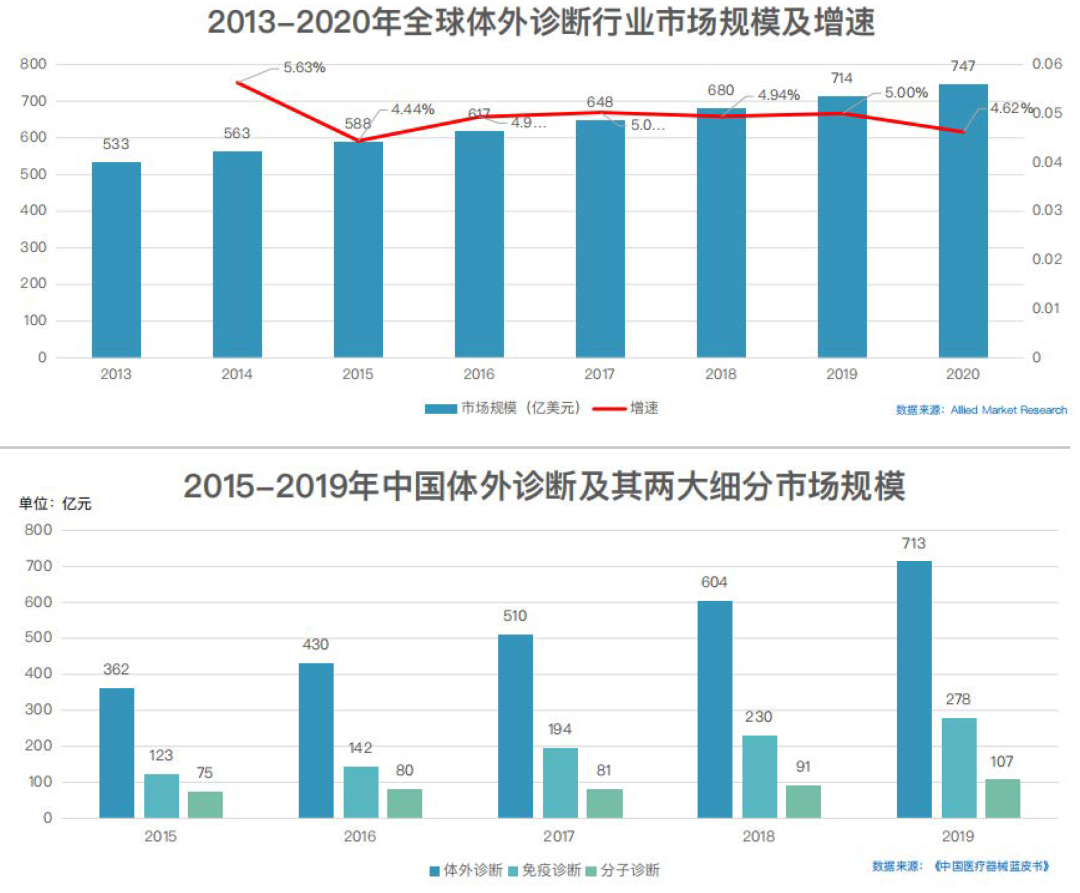
早在上个世纪70年代初就有科学家尝试使用生物微球来分离细胞,1969年科学家Wigzell和Andersson[1]就开始利用细胞表面抗原和特异性抗体的结合性质原理,使用生物微球分离细胞,所用生物微球没有磁性,分离速度慢,效率很低,且成本高昂。1976年科学家Guesdon和Avrameas[2]研究磁性的生物微球和抗原/抗体的连接反应,并在1977年成功开发磁性固相酶免疫分析技术,为将来使用磁珠来分离细胞以及更广阔的分子生物学研究应用打下基础。所用磁珠为法国Magnogel beads(MG beads),结构为4%的聚丙烯酰胺,4%的琼脂糖和7%包裹在磁珠里面的氧化铁,磁珠表面有醋酸基团,粒径范围为50-160um,属于羧基磁珠。
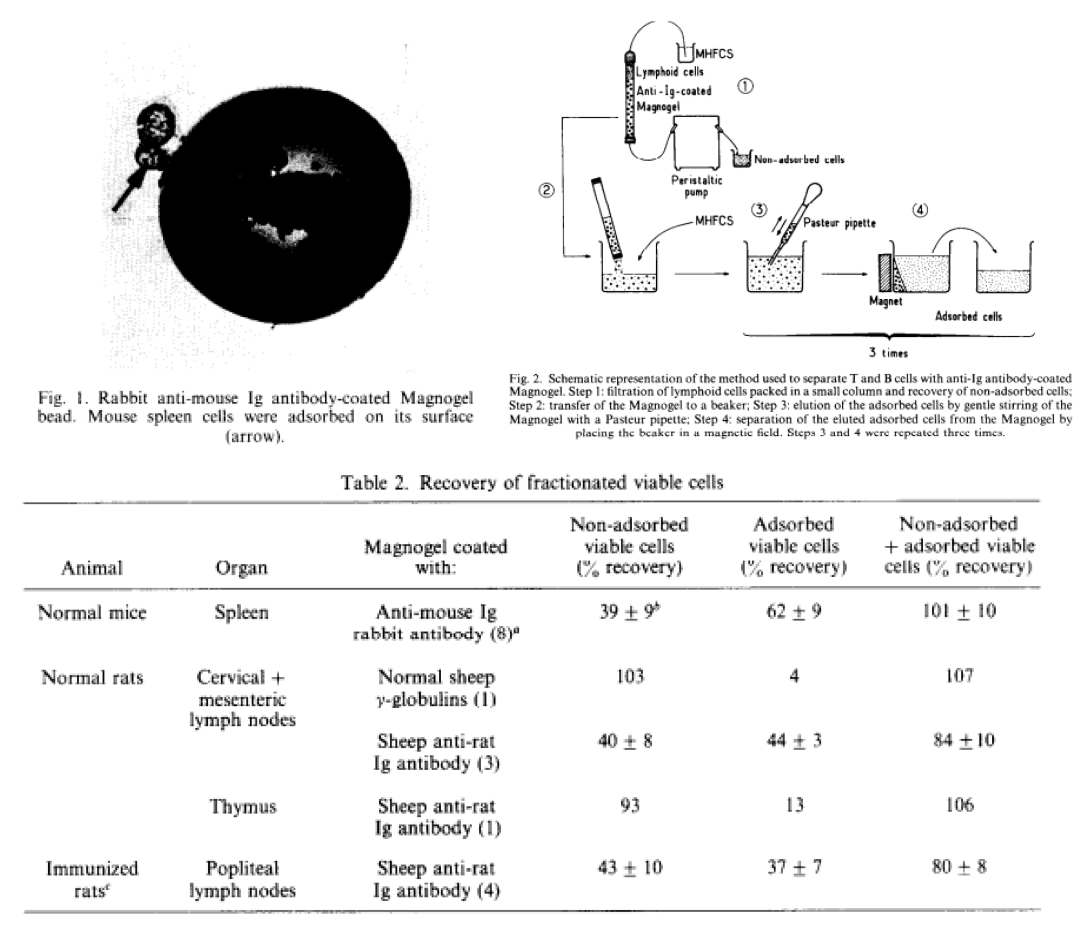
1978年科学家AntoineJC等[3]首先尝试使用磁性固相酶免疫分析技术来分离小鼠和大鼠淋巴细胞,并获得成功,分离速度快,总回收率在80%-100%之间,所用磁珠同样为法国的MG beads。
1982年科学家Meier和Lagenaur等[4]使用MG beads来分离少突胶质细胞,改善了分离实验方案,提高分离效率,分离后少突胶质细胞的纯度为91.4%,不仅分离速度快,且成本大大降了下来。
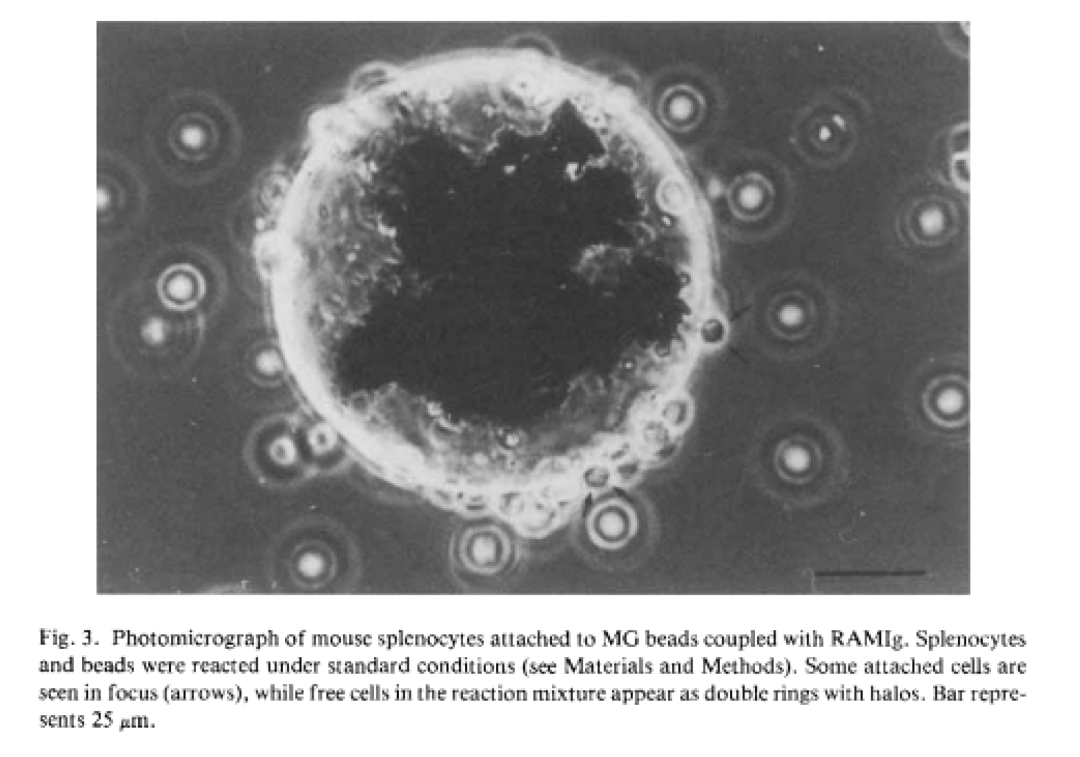
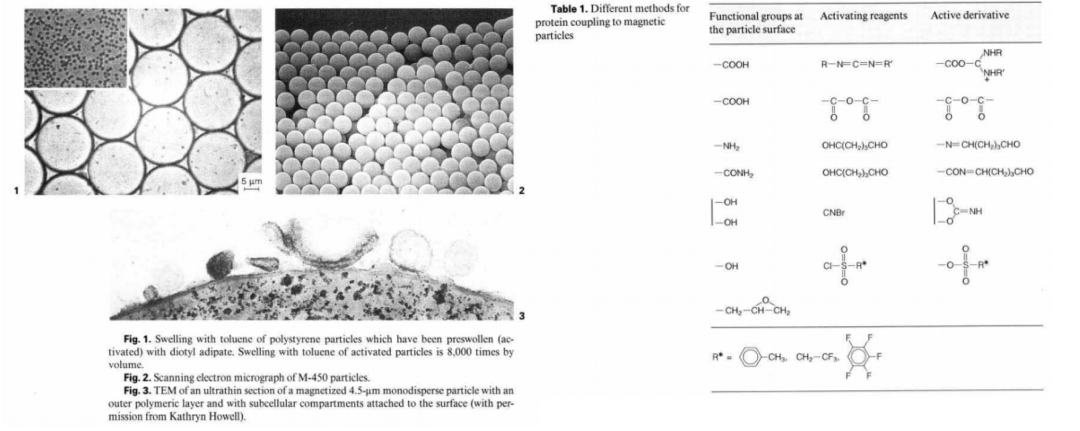
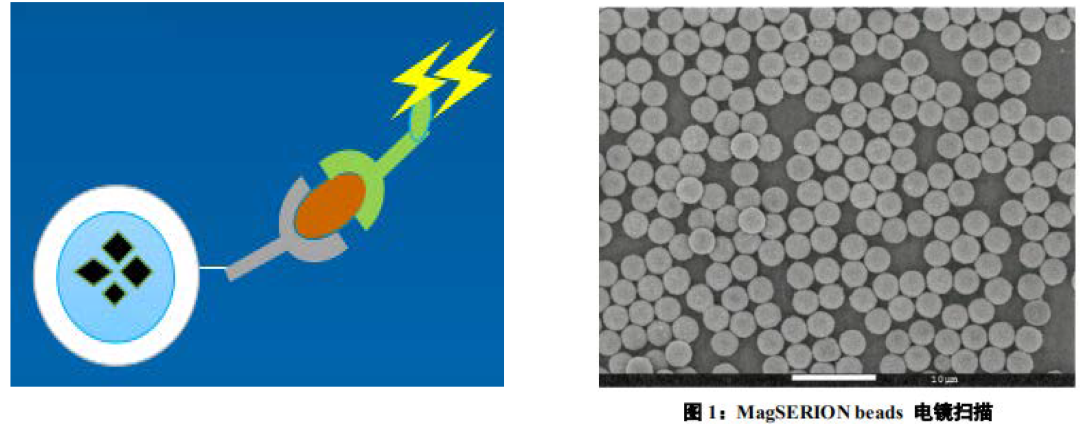
生物磁珠技术发展至今,不仅磁珠本身的制造工艺,而且磁珠分离细胞的技术均已经非常成熟,目前大部分磁珠厂家均有能应用于细胞分离的产品,技术成熟且比较知名的厂家有德国Miltenyi,美国Dynabeads,德国MagSERIONbeads,法国Ademtech等,大部分厂家均可以提供已经包被对应细胞表面抗原的抗体磁珠试剂盒,使用过程简单方便,而且主要是3.0um粒径或者更大的磁珠,比如美国Dynabeads主打4.5um。
除了细胞分离,核酸提取也可以通过无磁的生物微球来进行实验,包括琼脂糖和硅胶等,但是效率同样不高,通过磁珠来提取核酸的最佳方法是在磁珠表面接入链霉亲和素,再和生物素化配体结合,通过配体捕捉DNA/RNA。1989年科学家Hultman等[6]首先使用嫁接了链霉亲和素的Dynabeads来提取核酸并测序,所用磁珠为粒径2.8um的Dynabeads。除了链霉亲和素-生物素原理,使用Protein A/G磁珠捕捉抗体-蛋白质-DNA/RNA,也是常用的方法之一。主要的厂家有美国Dynabeads,美国GE,和美国BioVision等。
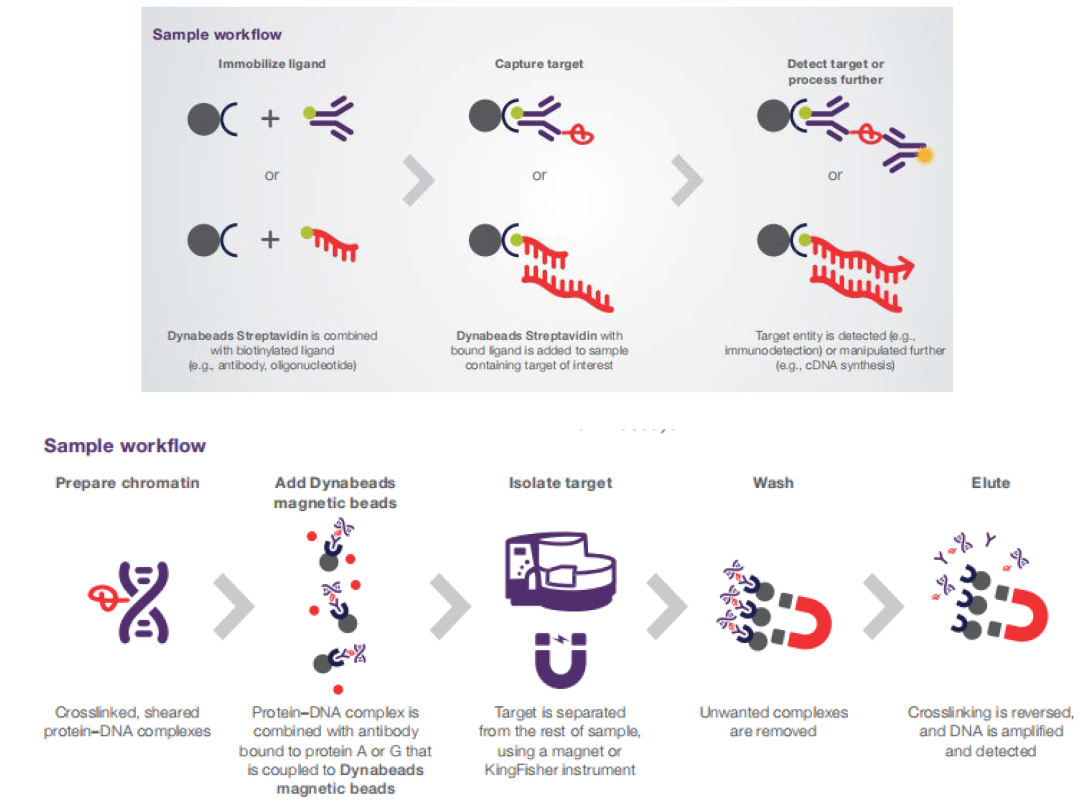
现在临床检测市场上普遍使用硅基材质的羟基/羧基磁珠来进行核酸提取,方法是磁珠在某种酸碱条件下和溶液中的核酸通过疏水作用、氢键作用和静电作用等发生特异性结合,迅速从生物样品中分离核酸,有利于核酸的自动化和高通量提取。这种针对临床检测市场的核酸提取磁珠技术比较成熟,已经基本实现国产化,操作简单方便。
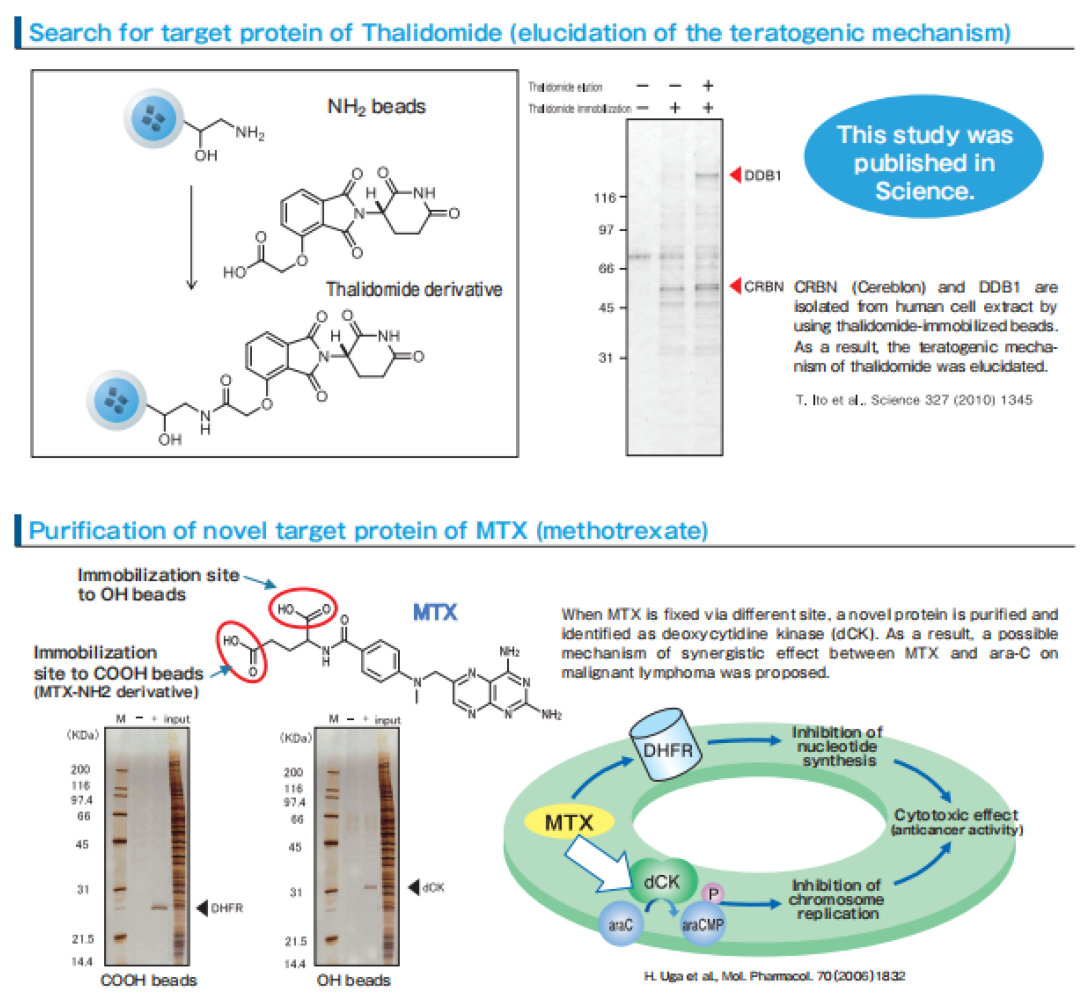
1990s年代日本科学家Hiroshi Handa等[7]开发FG beads,一种200nm粒径的聚苯乙烯材质的生物磁珠,可以在有机溶剂中和各种小分子或者生物大分子配体进行连接,研究这些配体的结合性质和代谢功能,主要应用于生物医药的靶点蛋白鉴定筛选和作用机理研究。
2006年科学家Hitoshi Uga等[8]用FG beads成功寻找抗癌药MTX的作用靶点并发现其抗癌机理。2010年科学家Takumi Ito等[9]用FG beads寻找镇静剂药物Thalidomide的作用靶点蛋白并弄清楚其作用机理。
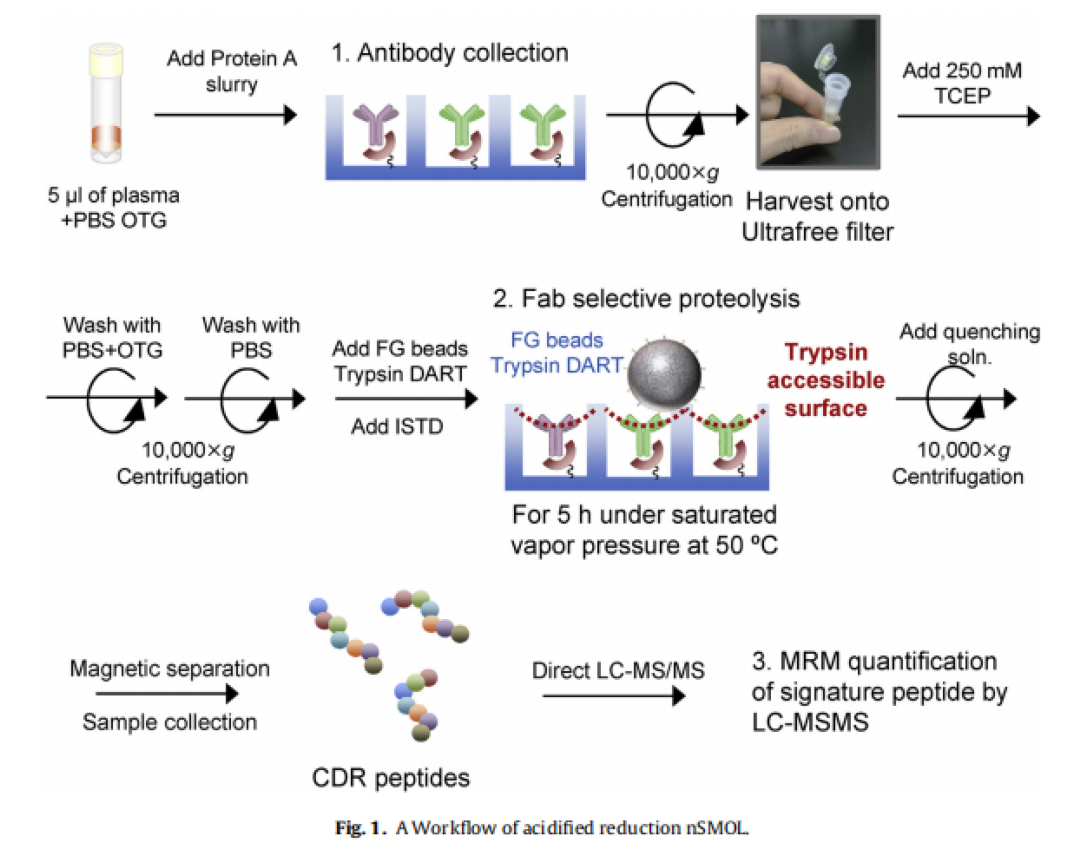
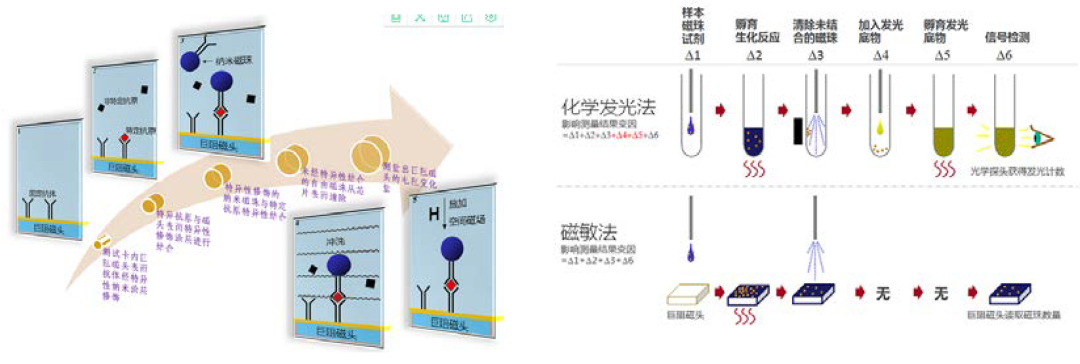
这是生物磁珠需求量最高的应用项目,所根据的原理起源于科学家Guesdon和Avrameas在1977年开发的磁性固相酶免疫分析技术,主要用来开发临床体外诊断(IVD)检测技术,通过用磁珠连接特异性抗体来寻找其作用蛋白/抗原并分离纯化,最终检测蛋白/抗原数量,主要的使用技术包括磁微粒化学发光免疫分析技术(CLIA)、微流控磁敏免疫分析技术(MIA)、荧光免疫分析技术(FIA)、单分子免疫检测技术等。
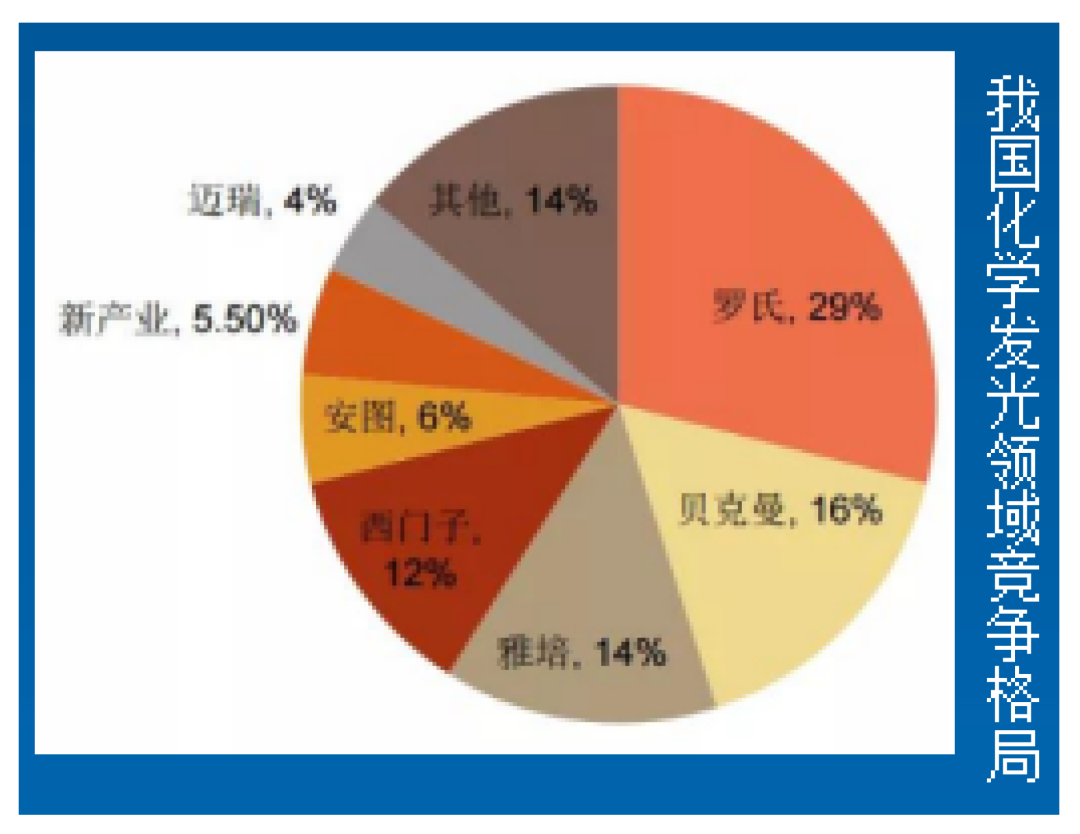
CLIA凭借其灵敏度高、特异性好、自动化程度高等优势,直接检测对象是发光材料的发光性质,最终计算蛋白/抗原数量,在临床应用中迅速推广,已经成为免疫诊断的主导技术,市场占有率超过70%,国内外IVD厂家众多。随着中国社会老龄化的增长,免疫诊断市场不断增长,2019年中国免疫诊断市场规模为278亿元。欧美发达国家免疫诊断中化学发光市场占比超90%,我国目前只有80%左右,且国产化学发光试剂占比不到20%,未来五年发展潜力巨大,有望突破50%。
MIA不同于CLIA,MIA首先需要结合微流控芯片技术,成本较高,采用磁敏传感器技术,用磁珠捕捉待测蛋白抗体并固定在芯片上,直接检测对象是带磁性的磁珠本体数量,具有更高的精度以及更快的检测速度。MIA是对磁信号的检测,可以消除生物样品的干扰,具有超高的灵敏度,并可同时检测多种疾病分子的能力。MIA主要使用200nm的链霉亲和素磁珠,对磁珠的粒径均一性和稳定性有高要求。这项技术在国内比较新颖,但微流控芯片成本较高,国内已有厂家在开发推广,能否全面走向临床应用有待观察。
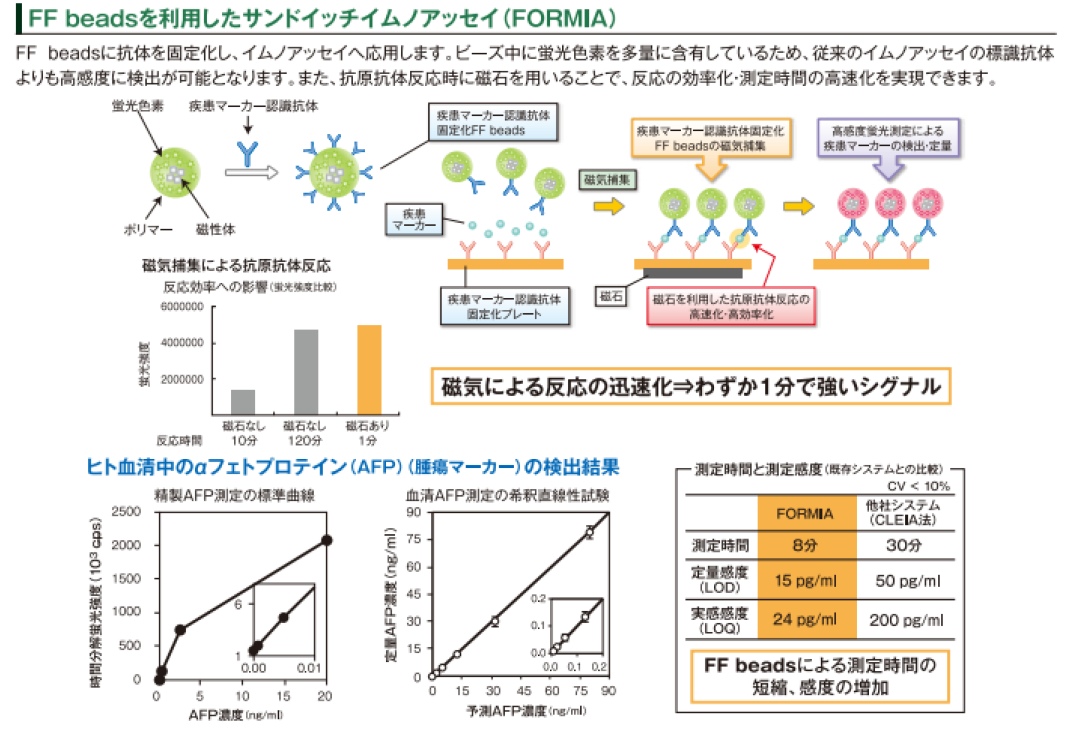
POCT是即时检测(Point-of-care testing),是IVD市场增长最快的领域,常用荧光免疫分析技术(FIA)来检测抗原/抗体,所用抗体载体多为无磁的纳米级别生物微球,或者胶体金,检测速度极快,且是傻瓜式操作,几个小时甚至十几分钟即可获得结果,技术成本比CLIA更低。但是FIA易受荧光材料本身的发光性质所影响,常用异硫氰酸荧光素(FITC),Ex-Em是490nm-530nm,灵敏度不高。为了提高检测灵敏度,目前主要用时间分辨荧光免疫技术(TRFIA),使用镧系元素铕螯合物(Eu)作为荧光材料,Ex-Em是340nm-616nm,极大地提高了分析灵敏度,是现有的免疫检测方法中灵敏度最高的、稳定性最好的免疫检测技术。市场上提供这种荧光微球的主要厂家是美国Bangsbeads、美国Invitrogen beads和日本TAMAGAWA的FS beads,以200nm粒径为主。
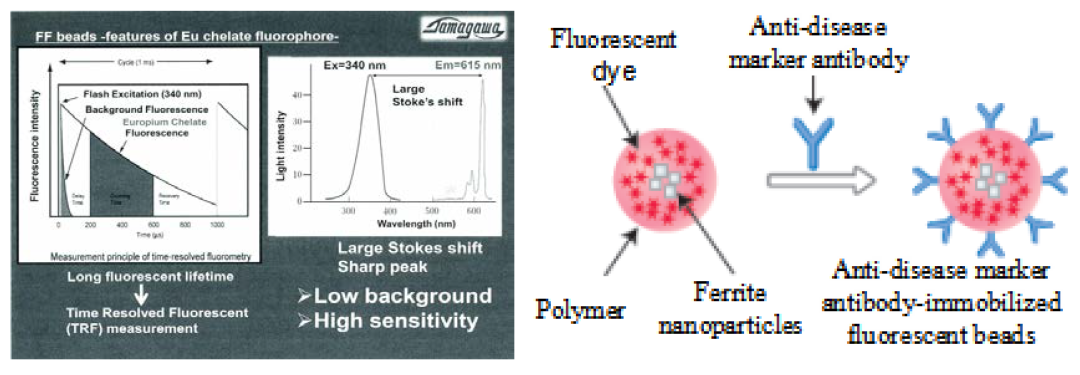
如果使用包含TRFIA荧光材料的磁珠作为抗体载体,结合TRFIA的检测灵敏度优势以及CLIA的自动化快速分离优势,CLIA就能通用于POCT市场。目前POCT市场上提供这种荧光磁珠的厂家主要有美国Spherotech beads,日本TAMAGAWA的FF beads。这种新型荧光免疫分析技术目前最大的问题是荧光磁珠本身,因为磁性和荧光材料会有相互干扰,导致磁性不足或者荧光强度不高,如何解决这两者的相容性问题是它走向临床IVD市场的最大条件。
(4) 单分子免疫检测技术
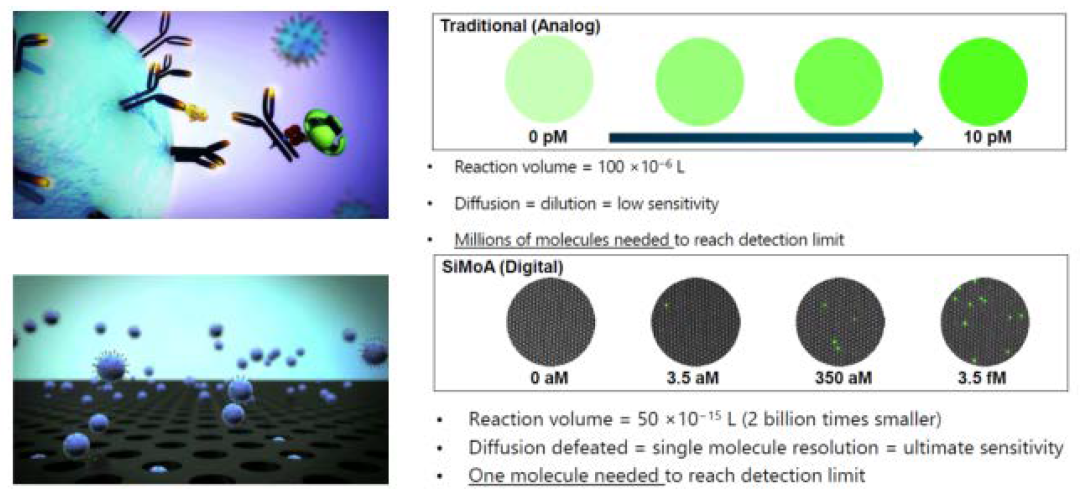
单分子免疫检测技术,顾名思义是通过对单个抗原分子的直接计数实现定量检测分析,打破业内对免疫检测灵敏度下限的认知,其灵敏度可达fg级别,一般的标记免疫技术(CLIA、荧光免疫等)最高的检测灵敏度一般在pg级别。单分子免疫检测技术主要用于美国Quanterix的SiMoA系统和德国默克的SMCxPro系统,结合微流控芯片技术,要求使用2.5-3.0um粒径的磁珠,粒径要绝对均一性,是对磁珠性能和条件最为苛刻的一种前沿技术,目前生产此粒径磁珠的主要厂家包括美国Dynabeads和德国MagSERIONbeads等。现在国内已经开始有IVD厂家开发单分子免疫检测技术,受限于微流控芯片技术成本高昂的条件限制,能否用于IVD市场有待观察。
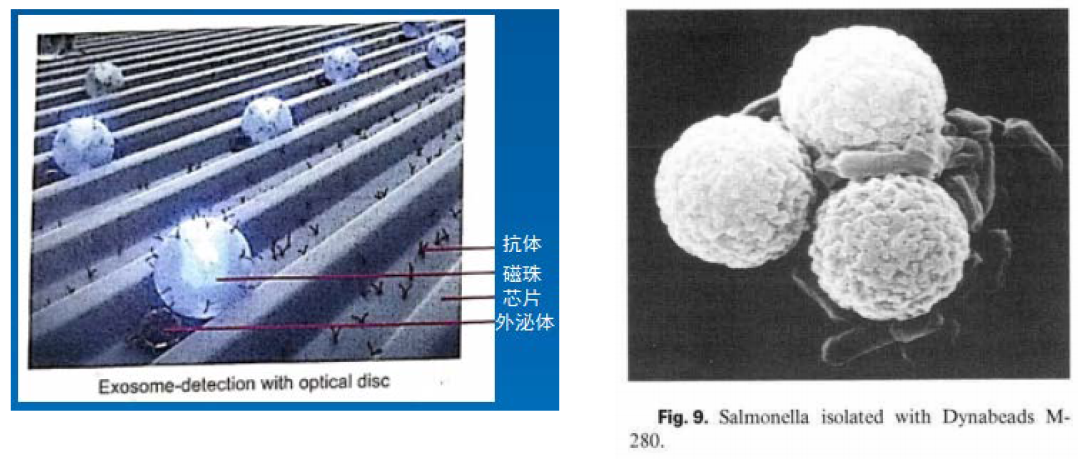
根据磁性固相酶免疫分析技术,只要在磁珠上接上特异性抗体,对于分离其他生物大分子或者特殊用途均可以使用磁珠来进行。比如纯化外泌体、分离细菌或者病毒,目前市面上厂家均有针对外泌体纯化用的磁珠产品,原理一致,具体方案根据外泌体性质会有很大不同,主要厂家包括美国Dynabeads和日本FG beads。
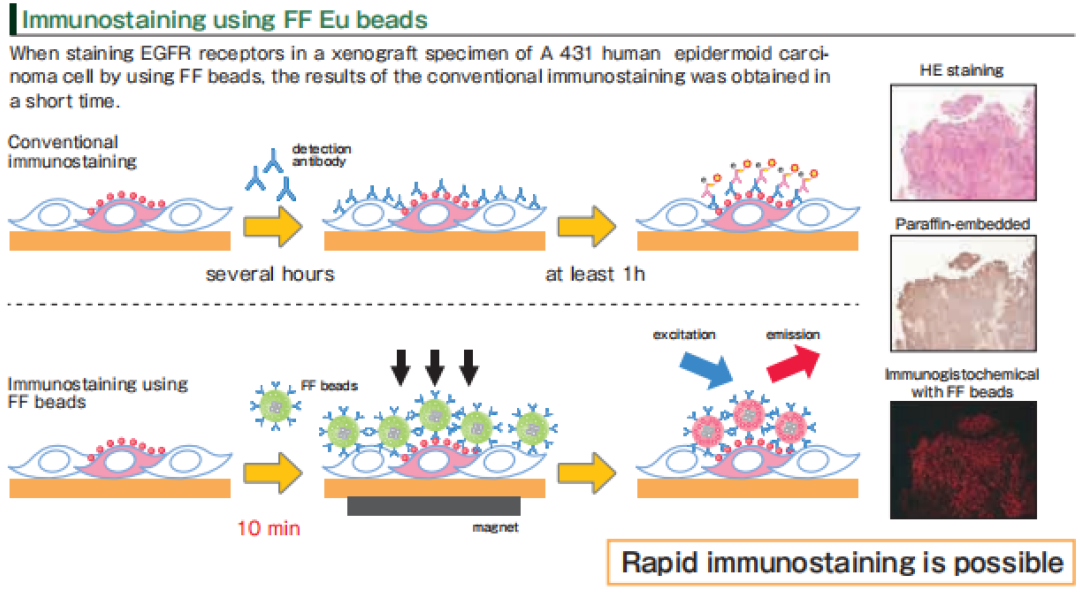
使用荧光磁珠还可以用于免疫染色,比传统方法速度更快。
以上分析了磁珠用于体外实验的主要应用领域,简述每种领域对磁珠的使用条件。临床IVD市场上的磁珠厂家众多,以进口为主,性能和价格参差不齐,市面上主流使用1-3um的羧基磁珠用来生产CLIA试剂,其他各种粒径的磁珠均可以用于不同的检测技术,要根据所用检测技术的条件筛选合适的磁珠产品。在学术科研领域,物小而精的生物磁珠,尤其在分子生物学方面的应用更加广阔,开阔了人类对生命科学的认识。

产品咨询

SERION原料事业部:
18818686988
0755-89381139

编辑:Steven | 校对:Harris | 责编:Hillson
干货分享


助力我们的客户更加强大
永葆我们的价值无可替代

免责声明:本文仅代表作者本人观点,不代表维润赛润资讯的观点和立场。文章图片均来源于网络,如有侵权,请联系作者删除,欢迎联系小编。

原文始发于微信公众号(维润赛润资讯):生物磁珠体外应用简述




