
-
德国维润赛润CACLP展位号:B5-0805
体外诊断试剂属于医疗器械范畴,但其在监管方面有着自己的一套法律法规,进行药监注册时,在注册检验和体系核查后需要进行临床试验,对于二类和三类体外诊断试剂需要的临床机构数量也有区别,今天主要介绍临床试验应该了解的一些相关概念和基本流程。

体外诊断试剂的临床研究(包括与已上市产品进行比较研究在内的临床验证)是指在相应的临床环境中,对其临床性能进行的系统性研究。
申请人应在符合要求的临床单位,在满足临床试验最低样本量要求的前提下,根据产品临床预期用途,相关疾病的流行率和统计学要求,制定能够证明其临床性能的临床试验方案,同时最大限度地控制试验误差,提高试验质量并对试验结果进行科学合理的分析。参与临床试验的各机构职责:
一,临床试验机构职责
项目立项,签订合同,项目启动及相关人员培训,临床试验质量控制,试验过程文件归档管理。
二,国家药物临床试验机构管理办公室职责
临床试验仪器设备及试剂签收,不良事件协调处理,结题归档资料审核及结题报告盖章,临床核查协调处理。
三,伦理委员会职责
伦理审查,受试者知情同意或免知情同意,监督临床试验项目按照已批准的临床方案执行。
四,项目实施机构职责(检验科)
参与立项,组建研究团队,临床方案的前期审查,确定临床费用,临床试验项目的实施,试验完成,出具临床研究报告。
五,申办方职责
挑选合格研究者,向研究者,研究中心研究人员提供正确开展研究所需的信息,确保研究中心对研究的正确管理,确保按照伦理批准的方案进行研究,建立研究器械的管理流程。
六,监察员(CRA)职责
申办方指定,沟通研究者,申办方以及试验机构,相应的资质,培训和经验监查,报告的试验数据正确,完整,与原始文件一致。试验的开展遵守现行批准的方案,修正案,GCP和使用法规要求。
临床试验实施流程
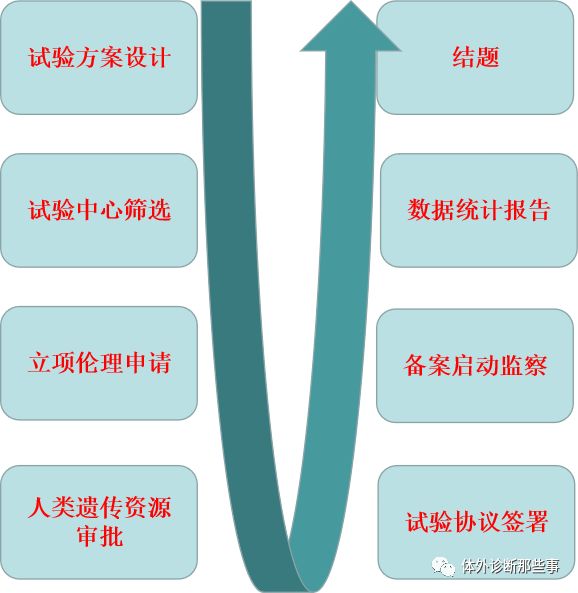
我们以某三甲医院为例进行临床试验流程的讲述
首先需要进行项目立项,需要解决的问题有审核项目开展的可行性,确定主要研究者PI,PI提出项目研究者团队成员,成员的资质审核等。
第二步进行复审,审查所需要的相应文件。
第三开始签署协议,一般包括项目名称,协议编号,双方需承担的责任与义务,研究费用及结算方式,项目时间进度安排,协议违约处理办法等。
随后进行临床备案,包括备案表,申办者或代理人的营业执照,伦理委员会意见,申办者与临床试验机构实施临床试验协议或合同,医疗器械临床试验批件复印件等资料。
接下来试验前的准备工作,检测系统的验证,试剂的质控。
第六人类遗传资源的申请。
第七试验的启动,会开展项目启动会,主要参会人员有申办方,CRA/CRC,机构办相关人员,PI及研究团队,会进行相应的培训等,在进行正式试验前需要进行预试验,针对人员的培训,熟悉仪器试剂的使用,性能。继而进行正式试验,对结果进行统计学分析,攥写试验报告。
最后对整个过程的质量管理,试验过程的前中后进行质量控制,进行结题和资料归档。

从整个流程来看,可见临床试验的每一步是多么的严谨,当然中间也会遇到各种各样的问题。一个试剂盒的研发到上市之路看似简单,实则却要经历大大小小的各类流程,解决各种技术问题,因此想要做好研发,不仅是专业知识技能的储备,临床背景的掌握,更重要的是熟悉相关法律法规,我的每篇文章都是以一个研发者的第一视角去进行的分享,感谢大家的关注和支持,以后会输出更多的干货!

公司简介
助力我们的客户更加强大
永葆我们的价值无可替代







