

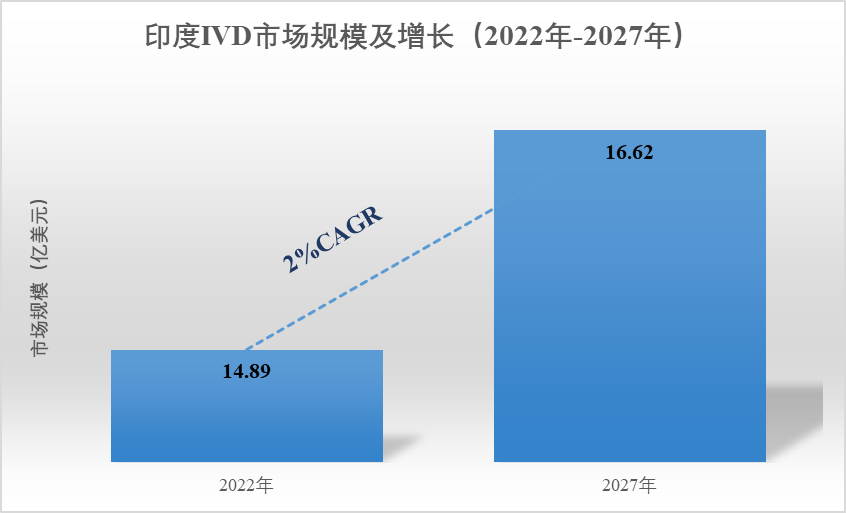
据Kalorama Information报告,印度是亚洲最大的医疗市场之一,2022年印度的IVD市场规模约为14.89亿美元,预计2027年的IVD市场规模近16.63亿美元,其2022年-2027年的年复合增长率(CAGR)约为2%。
二、印度IVD市场的细分领域

图3:印度IVD市场的细分领域占比(2022年)
三、印度IVD市场机遇
1、人口老龄化增加
到2060年,65岁以上人口预计占总人口的14.1%。
2、传染病
印度是个传染病风险极高的国家,如水源、食物等传播引起的细菌性腹泻、甲肝、戊肝及伤寒等。虫媒传染病引起的登革热、克里米亚-刚果热、日本脑炎、疟疾等。在印度约有超过230万人感染艾滋病,世界第二,仅次于南非。在印度,每年约有250万-300万人感染结核,结核病例总量约占全球的1/4。
3、肥胖率增加
据报道,印度的肥胖人口数量约占总人数的5%(约7143万人)。此外,印度面临着5岁以下儿童体重不足和营养不良的高比率(35%体重不足)。
4、非传染性疾病增加,尤其是糖尿病、肥胖症、心血管疾病负担增加,尤其是POC市场的需求扩大。
5、政府对健康解决方案及技术的大力支持
四、印度的医疗体系
据报道,印度约有10万个上市的实验室分布在一线城市。未上市和未受监管的实验室主要分布在二线和三线城市,其数量约为一线城市的2倍之多。
五、印度IVD的监管及注册
2018年1月,印度根据《医疗器械管理条例2017》(Medical Device Rules 2017)将医疗器械分为A到D四类,对应从低风险到高风险四种风险级别。

表1:印度医疗器械分类
1)测试和文件审核的流程
测试可以与文件同步进行,确认文件由印度授权代表进行递交 (需要得到ICMR的测试结果或授权), CDSCO官方披露7天给予首轮回复(是否需要补件或者直接批复)。
2)文件准备要求
文件准备以MD-16, MD-14和Plant Master File为主,根据ICMR要求, 进口测试样品需使用MD-16 表单,并将产品送交ICMR进行检测。CDSCO受理批准后办理MD-15(Import License Form) 证书进行进口, 最终证书有效期 5年。
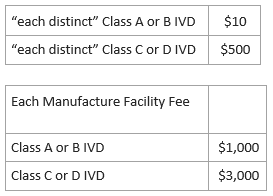
3)官方费用
医疗器械注册证书, 10 美元-1500美元, 一个场所注册费用, 1000-3000美元。
参考来源:
【1】Kalorama Information
【2】公众号:印度和其他亚洲市场,发展与想象并存,老炮们聊一聊亚洲体外诊断试剂市场之二
【3】公众号:维润赛润资讯,印度家庭自检市场
【4】公众号:CACLP体外诊断资讯,印度医疗器械准入条件及紧急注册流程
公司简介 德国维润赛润(Institut VirionSerion GmbH)成立于1978年,是国际知名的诊断产业原料生产商和供应商。公司的研发和生产基地位于德国维尔茨堡,已通过DIN EN ISO 13485质量体系认证,拥有三级生物安全实验室(P3实验室)。经过了40余年的发展,公司构建了丰富的生物原料产品线,主要包括天然抗原、重组抗原、人源化单克隆抗体和磁珠等。 助力我们的客户更加强大 永葆我们的价值无可替代


免责声明:本文仅代表作者本人观点,不代表维润赛润资讯的观点和立场。文章图片均来源于网络,如有侵权,请联系作者删除,欢迎联系小编。




