文章来源:中华检验医学杂志, 2023,46(6) : 541-557
作者:中国医疗保健国际交流促进会临床微生物学分会 中华医学会检验医学分会临床微生物学组 中华医学会微生物学和免疫学分会微生物学组
摘要
侵袭性真菌病(invasive fungal disease,IFD)即侵袭性真菌感染(invasive fungal infection,IFI),病死率高,是国际、国内关注的焦点[1]。近期世界卫生组织发布优先真菌病原清单是国际关注的集中体现[2]。其他感染病流行期间也有涉及[3]。按照欧洲癌症研究与治疗组织和真菌研究小组教育与研究联合会(European Organization for Research and Treatment of Cancer and the Mycoses Study Group Education and Research Consortium,EORTC/MSGERC)标准[4],IFD诊断分为3层,包括确定诊断、极似诊断和初拟诊断。确定诊断和极似诊断对应有不同的真菌学检查、影像学检查等。真菌学检查中,适应证具有不确定性,部分检查的操作和结果解释有挑战性,同时,部分检测技术和项目尚难以普及。中国医疗保健国际交流促进会临床微生物学分会联合中华医学会检验医学分会临床微生物学组和微生物学和免疫学分会临床微生物学组组织专家撰写本指南。本指南主要包括适应证、样本、检测技术、结果解释和会诊等内容,目的是析疑解难、促进学科发展,为临床诊疗防控等提供专业帮助,为患者治病康复提供可靠服务。 指南制定过程:(1)王辉教授牵头,中国医疗保健国际交流促进会临床微生物学分会、中华医学会检验医学分会临床微生物学组和中华医学会微生物学和免疫学分会临床微生物学组专家形成工作组。(2)确定执笔专家和汇总专家。(3)指南启动会,两次讨论会和定稿会。方法:参照推荐评估的分级、制定和评价(Grading of Recommendations Assessment,Development and Evaluations,GRADE)方法,工作组对文献质量进行了评价,形成指南的初步文本。经讨论会讨论,最终确定推荐意见。并给出了推荐强度、证据质量等级(表1)。推荐强度分2级:强和弱。证据质量分3级:高、中、低。
一、适应证 1.念珠菌菌血症和其他念珠菌感染:推荐对有临床特征(持续发热、规范抗细菌治疗无效)同时合并风险因素(抗菌药物的使用、持续粒细胞缺乏、实体器官或干细胞移植、置入导管、全肠外营养、腹腔手术、胰腺炎、糖皮质激素、其他免疫抑制剂的使用等)患者进行相关样本的念珠菌镜检和培养等检查[4](强,中)。老年、入住重症监护室(intensive care unit,ICU)、机械通气、器官衰竭评分高等也是侵袭性念珠菌病(invasive candidiasis,IC),包括新型冠状病毒感染相关念珠菌病(COVID-19-associated candidiasis,CAC)的风险因素。中心静脉导管感染需要特别关注近平滑念珠菌等。下呼吸道样本直接镜检和分离培养出的念珠菌无法区分定植与感染,临床意义有限,常规不推荐进行鉴定和药敏试验[5](强,低)。对所有疑诊IC的患者,推荐进行血液真菌培养,以提高病原学诊断阳性率[6](强,中)。一旦确定念珠菌菌血症的诊断,推荐规律复查血培养,直到至少连续两次血培养结果阴性[5](强,中)。推荐进行真菌的(1,3)-β-D葡聚糖检测(G实验)(强,中),感染早期G实验即可呈阳性,阴性预测值(negative predictive value,NPV)较高[7]。怀疑IC,尤其是念珠菌菌血症时,推荐进行血液样本直接聚合酶链反应(polymerase chain reaction,PCR)检测(强,高)。与常规血培养相比,该检查具有更高的敏感度,特异度为90%[8]。临床可考虑常规开展念珠菌对唑类药物的敏感试验,耐药菌感染史、耐药菌高流行区、迁延不愈者,尤其应该进行敏感试验[9, 10](弱,低)。棘白菌素类药物敏感试验主要用于3种情况:近期有棘白菌素暴露史;近平滑念珠菌、光滑念珠菌、耳念珠菌所致感染需要用药;抗真菌治疗超过1周仍能分离出致病念珠菌[9,11](强,低)。 2.曲霉病:推荐对具有侵袭性曲霉病(invasive aspergillosis,IA)风险因素或怀疑IA的患者进行相关样本的镜检与培养 [12](强,中)。IA风险因素包括:血液系统恶性肿瘤、慢性肺部疾病、移植(实体和骨髓)、糖皮质激素治疗、中性粒细胞缺乏和慢性肝病,也包括使用免疫抑制剂、结构性肺病和肺部血管疾病、入住ICU、老年等。急性呼吸衰竭的新型冠状病毒感染(COVID-19)患者,特别是有创通气时,使用糖皮质激素或托珠单抗治疗时,尤其需要注意COVID-19相关肺曲霉病(COVID-19-associated pulmonary aspergillosis,CAPA)。考虑曲霉感染时,建议增加痰样本的送检次数,以增加IA诊断的阳性率[13](弱,中)。痰样本一般每天送检1次,不超过2次,连续2~3 d。支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中曲霉培养阳性时,推荐结合临床表现和影像学有意义特征,考虑诊断为感染而非定植[14](强,中)。怀疑IA时,推荐采集组织活检样本,可应用六胺银染色和过碘酸雪夫染色识别真菌形态和结构[15, 16](强,中)。由于全球的曲霉耐药率仍然较低,初次治疗患者不推荐常规进行药敏检测。但如果出于流行病学和耐药监测目的,可对IA病例中分离的菌株进行药敏检测。治疗失败时,推荐进行药敏检测[17, 18, 19, 20](强,中)。由于特异性较差,一般而言,不推荐G实验用于IA诊断[21](弱,中)。建议G实验联合其他诊断方法(如GM试验、曲霉PCR检测)用于血液系统恶性肿瘤患者的IA诊断[22, 23](强,高)。建议G实验用于免疫抑制的重症患者IA的诊断和筛查[24, 25](强,中)。推荐血清半乳甘露聚糖(galactomannan,GM)检测用于中性粒细胞缺乏患者疑似IA时的诊断[26](强,高)。建议血清GM用于非粒细胞缺乏患者血液系统恶性肿瘤等情况时疑似IA的诊断(弱,中)[27, 28]。不推荐血清GM用于慢性阻塞性肺病等非免疫抑制患者的IA单独诊断[29](弱,中)。不推荐血清GM用于慢性肺曲霉病诊断[30](弱,中)。推荐血清GM用于IA患者治疗效果的监测[31](弱,中),但不建议其用于已使用预防性抗真菌治疗的无症状患者的监测和筛查[32](弱,中)。对于非粒细胞缺乏患者,推荐对BALF进行GM检测,用于诊断IA[33, 34, 35](强,高)。对于影像学高度怀疑慢性肺曲霉病患者,推荐进行曲霉IgG抗体检测[36, 37, 38, 39](弱,中)。曲霉IgG抗体在曲霉结节中的诊断价值缺乏文献报道。怀疑IA时,推荐进行BALF的曲霉PCR检测(强,中)。推荐连续2次,或2个及以上样本检测[40, 41, 42]。血液样本曲霉PCR可用于血液系统恶性肿瘤的IA诊断[43](强,中)。 3.肺毛霉感染/毛霉病:已有基础疾病的患者发生发热伴咯血或其他呼吸道表现、且进展迅速,肺部CT提示局灶性实变、包块、胸腔积液或多发结节或“真菌感染可能”,推荐进行痰液、BALF、组织活检(针吸或切片)的真菌染色和培养检查[44, 45, 46, 47, 48, 49](强,高)。基础疾病包括:糖尿病(尤其是酮症酸中毒,或控制不佳)、中性粒细胞缺乏、实体器官移植和造血干细胞移植受者、恶性肿瘤、铁过载、脓毒症、HIV感染等。风险因素还包括:各种原因导致免疫功能低下、外伤、使用广谱抗细菌药物、孢子环境暴露等。罹患COVID-19时,血液病与实体器官移植、使用免疫抑制剂、粒细胞减少、糖尿病控制不佳、使用糖皮质激素,须注意COVID-19相关毛霉病(COVID-19-associated mucormycosis,CAM)。糖尿病(尤其是酮症酸中毒)患者发生发热伴或不伴鼻溃疡或坏死、眶周或面部肿胀、视力减退、眼肌麻痹、鼻窦炎、头痛、神志改变,需立即进行相应部位分泌物或组织(针吸或切片)的真菌染色镜检和培养[45, 46, 47, 48, 49, 50](强,高)。 4.耶氏肺孢子菌肺炎(Pneumocystis jiroveci pneumonia,PJP)/肺孢子菌感染:HIV感染者出现肺炎,亚急性起病,出现发热、干咳、进行性呼吸困难和低氧血症等临床表现,肺CT显示双侧多发弥漫性间质改变,累及肺门周围区域的双侧肺间质病变和肺泡浸润,双侧弥漫性毛玻璃样改变,推荐进行PJP病原学检测[50, 51, 52, 53](强,中)。PJP的风险因素包括:艾滋病、癌症、伴有器官移植(尤其是肾移植)的医源性免疫抑制、自身免疫性和炎症性疾病、肾病综合征等。检查方法包括特殊染色(如六胺银染色)、分子生物学检查(如PCR)、G实验和乳酸脱氢酶(lactic dehydrogenase,LDH)。后两者NPV较高,美国移植学会强调G实验及LDH同时阴性对PJP有较高的NPV。非HIV感染的免疫缺陷患者(包括血液系统恶性肿瘤、实体瘤、器官移植、自身免疫性疾病、接受化疗药物、免疫抑制剂或生物治疗)出现肺炎,急性起病,出现发热、干咳、呼吸困难、低氧血症,肺CT显示肺间质纹理增强,双侧磨玻璃样改变,伴片状实变,推荐进行PJP的镜检和核酸检测[50, 51, 52, 53](强,中)。非HIV感染的PJP患者治疗一周后推荐进行肺CT检查以评价疗效,对治疗失败者应再次进行支气管镜检查和支气管肺泡灌洗以证实有无合并感染。不推荐采用肺孢子菌的PCR结果和血清G实验进行疗效评价[54](强,中)。PJP发生医院感染暴发时,建议对该病区患者(包括免疫抑制患者及免疫正常者)进行呼吸道样本耶氏肺孢子菌筛查,包括基因型别的筛查[51,55, 56](弱,低)。 5.肺隐球菌病和隐球菌脑膜炎:免疫功能低下的患者(如HIV/AIDS、淋巴瘤、实体肿瘤、长期服用糖皮质激素等)出现咳嗽、呼吸急促、咯血等呼吸道症状,肺CT提示肺部病变,高度怀疑为肺隐球菌病时,推荐进行痰液、BALF、细针抽吸物或肺活检切片的隐球菌染色和培养。有肺部症状且有胸腔积液时,推荐进行隐球菌抗原(cryptococcus antigen,CrAg)检测[57, 58, 59, 60](强,高)。注意试剂盒说明书样本范围。免疫功能低下的患者(如HIV/AIDS、淋巴瘤、实体肿瘤、长期服用糖皮质激素等)出现头痛、精神错乱、视力和听力障碍等中枢神经系统的症状,高度怀疑为隐球菌脑膜炎时,推荐进行脑脊液隐球菌培养、脑脊液墨汁染色、脑脊液CrAg检测等[57, 58, 59, 60, 61](强,高)。影像学检查(特别是肺部及颅内)发现异常,而怀疑隐球菌病的患者,推荐进行血培养、血清隐球菌CrAg检测[57,59,62, 63](强,中)。不推荐对隐球菌感染患者常规进行抗真菌药敏试验。以下情况进行药敏试验[57,63]:(1)与氟康唑最低抑菌浓度(minimum inhibitory concentration,MIC)增加相关的格特隐球菌感染者;(2)初始治疗失败或复发的新型隐球菌感染者;(3)近期有抗真菌药物暴露(如氟康唑预防使用)的隐球菌感染者;(4)无法准确区分新型隐球菌和格特隐球菌时(强,中)。 6.马尔尼菲篮状菌感染:怀疑马尔尼菲篮状菌感染时,推荐采集感染部位样本进行真菌涂片镜检、培养、PCR或宏基因组下一代测序技术(metagenomic next-generation sequencing,mNGS)等方法检测(强,低)。可以考虑外周血液和骨髓样本。HIV阳性患者感染马尔尼菲篮状菌常表现为播散性感染,侵犯多个器官。马尔尼菲篮状菌侵袭性感染的风险因素包括:急危重症和免疫功能低下者,如艾滋病患者(风险因素是CD4计数低)、癌症或器官移植患者。对于局部感染为主要表现,考虑为该菌感染的患者,推荐采集感染部位的样本进行真菌培养、涂片镜检、PCR或mNGS方法检测[4,64, 65](强,低)。对于疑似肺部马尔尼菲篮状菌感染患者,推荐采集痰液、BALF、肺病变部位细针抽吸物或肺活检切片进行染色镜检、培养、PCR或mNGS方法检测(强,低)。首发症状在皮肤,且考虑皮肤马尔尼菲篮状菌感染时,或确诊了皮肤马尔尼菲篮状菌感染时,除皮损部位分泌物或皮肤活检外,建议进行系统性判断,看是否播散性感染(弱,低)。 7.镰刀菌感染:当免疫缺陷人群发生肺部、皮肤等部位的感染、且对经验性抗菌治疗没有反应时,需要检测是否存在镰刀菌感染,推荐采集感染部位的样本进行真菌涂片镜检、真菌培养、PCR或mNGS方法检测(强,低)。侵袭性镰刀菌感染的风险因素包括急性髓系白血病、异体造血干细胞移植、巨细胞病毒再激活和基线时镰刀菌阳性皮损的存在。少数情况下,镰刀菌感染的患者可能表现为单一器官受损伤,如关节炎和鼻窦炎,或导管相关真菌血症[4,66]。推荐采集关节穿刺液、鼻窦吸出物等感染部位的样本进行涂片染色镜检、培养、PCR或mNGS方法检测(强,低)。 8.赛多孢感染和多育节荚孢霉感染:赛多孢是一种透明丝状真菌,广泛存在于土壤和污水中。赛多孢和多育节荚孢霉是引起人类感染的2种重要的丝状真菌。我国波氏赛多孢较为常见(约占60%)。多育节荚孢霉更为致命,死亡率高达77%。赛多孢感染病例在世界各地均有报道,从局部感染到播散性疾病不等。赛多孢感染的风险因素包括恶性肿瘤、实体器官移植、溺水和雪崩等,可以引起各个部位感染,没有具体器官的嗜好性。多育节荚孢霉可引起院内感染。对于疑似赛多孢感染引起的足菌肿的患者,推荐采集皮损部位分泌物或皮肤活检进行染色镜检、培养、PCR或mNGS方法检测(强,低)。疑似赛多孢引起软组织和手术伤口感染、关节炎和骨髓炎、耳真菌病、鼻窦炎、支气管过敏、眼部感染、血管假体感染、心内膜炎和播散性感染、中枢神经系统感染时[66, 67, 68],推荐采集感染部位的样本进行真菌培养、涂片镜检、PCR或mNGS方法检测(强,低)。对于溺水、雪崩患者,高度怀疑赛多孢引起肺部感染时,推荐采集BALF、胸腔积液、肺病变部位细针抽吸物或肺活检切片进行染色镜检、培养、PCR或mNGS方法检测(强,低)。
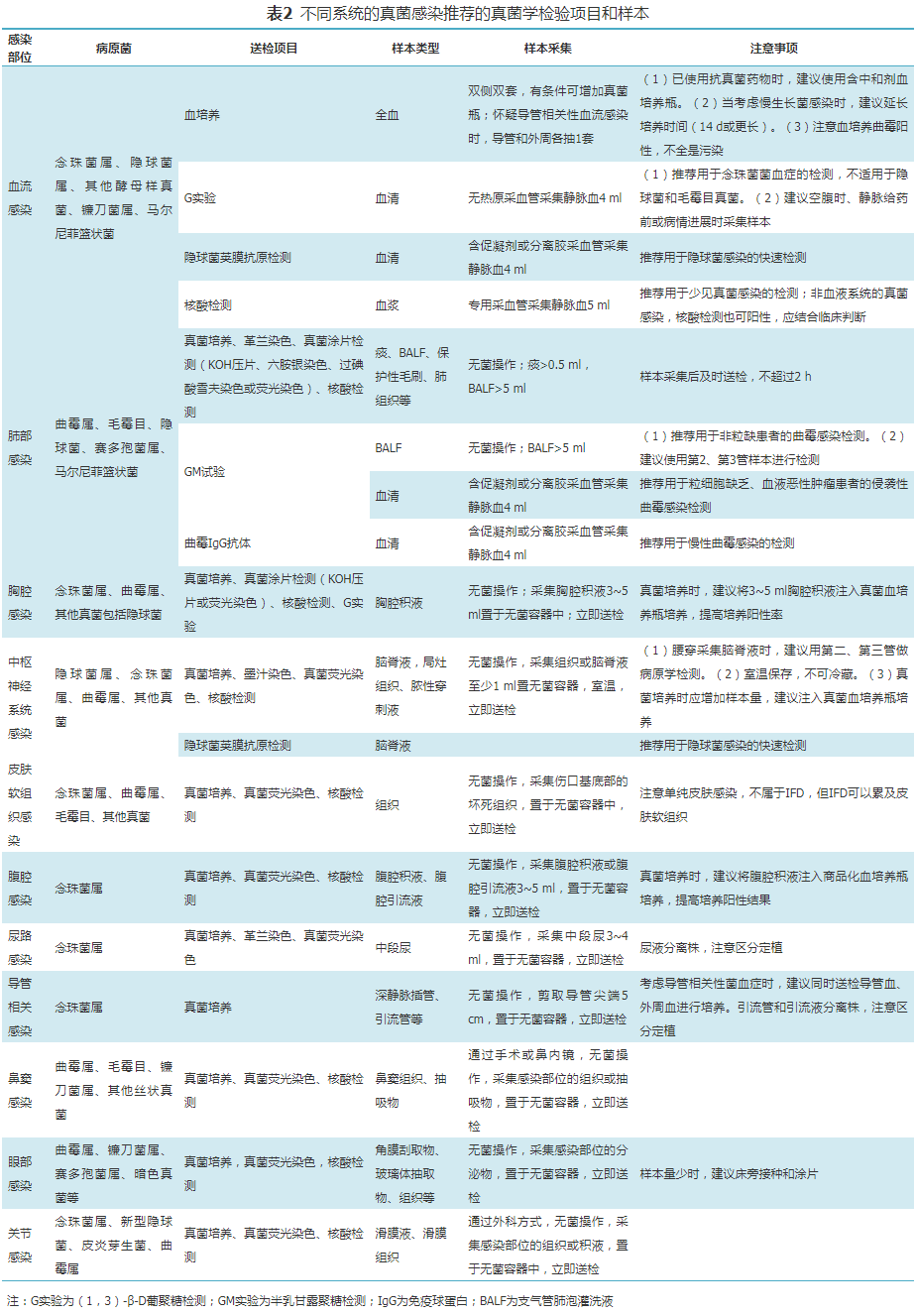
二、样本 重视微生物学样本的采集和送检对于诊断IFD非常重要[69]。相对于细菌、病毒感染,真菌感染样本采集具有一定的特殊性。表2汇总了常见真菌在不同系统感染中的采集要求和策略。对于临床疑似真菌感染的患者,推荐先采集微生物样本送检,再使用抗真菌药物进行治疗[70](强,低)。推荐从无菌部位采集样本;从有菌部位采集样本时,应尽可能减少正常菌群的干扰[64,71](强,低)。推荐真菌样本送检前填写真菌检验申请单,申请单除常规内容外,建议添加真菌感染的风险因素、真菌感染的症状和体征、生物标记物[如:C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、GM、G实验等]结果等[63](弱,低)。
1.血液:以下情况推荐进行真菌血培养。包括:血流感染(考虑酵母样真菌、丝状真菌和双相真菌)、导管相关性血流感染(考虑酵母样真菌)、心包炎和心肌炎、免疫受损患者会厌炎和声门上炎(考虑曲霉、其他丝状真菌)、免疫受损患者肺部感染(考虑镰刀菌属、荚膜组织胞浆菌)、烧伤创面感染(考虑念珠菌、曲霉、镰刀菌、链格孢、毛霉目)、手术部位感染(考虑念珠菌)、皮肤和皮下组织真菌感染(考虑申克孢子丝菌、地霉、马拉色菌、毛霉目)、自体瓣膜心内膜炎且患者吸毒或有严重基础性疾病;人工瓣膜心内膜炎;新型隐球菌脑膜炎或肺炎[66,71](强,中)。成人进行血培养后,如果病情持续或加重而临床始终不能除外菌血症,且首次血培养48~72 h阴性,建议隔1~2 d后重复进行1~2次血培养,每次2套4瓶[70](强,中)。 2.骨髓:推荐骨髓穿刺首选解剖部位是髂后嵴。如果患者不能活动,可以使用髂前嵴。婴儿可使用胫骨内侧表面[67](强,低)。 3.呼吸道样本(痰液、BALF等):推荐刷牙漱口后采集自气管深部咳出的晨痰,体积≥0.5 ml。推荐挑取含脓液、血液、黏液的部分进行镜检及培养[64](强,低)。怀疑曲霉感染时,建议进行大体积的未处理痰液和BALF培养[68](弱,低)。对于疑似真菌感染患者,收集BALF样本时应不添加任何固定液,立即送检,不推荐冷藏样本择期送检(弱,低)。推荐用BALF检测GM以诊断是否为侵袭性真菌感染[72](弱,中)。 4.脑脊液:注意脑脊液采集的适应证(如考虑中枢神经系统感染,不除外真菌病原的情况)、禁忌证(如颅内高压)。墨汁染色、隐球菌荚膜抗原检测等是急查项目,采集后推荐立即送检,实验室接到后立即处理、报告。脑脊液涂片、培养等阳性结果按照危急值进行处理[58,61](强,中)。 5.眼部样本:采集样本时若病变处分泌物过多,先用无菌湿棉签去除分泌物再选取病变处样本,立即送检。常温保存不超过 2 h(强,低)。直接显微镜检查有助于结膜炎的初步诊断,推荐采集2根拭子,1根用于培养,另1根用于制备涂片(强,低)。曲霉属推荐进行KOH涂片镜检,镰刀菌及暗色真菌推荐进行真菌培养,若发现真菌成分并结合临床症状可确诊侵袭性真菌感染[71](强,高)。 6.穿刺液(胸腔积液和腹腔积液):对于念珠菌性腹膜炎患者,建议早期进行腹腔积液样本培养。推荐手术或经皮穿刺收集的坏死或化脓性样本作为念珠菌腹膜炎微生物学诊断的样本,当怀疑有念珠菌时,推荐收集至少1 ml腹腔液体或1 g组织接种到培养基[73](强,高)。对于继发于肺隐球菌感染的胸腔积液,推荐在真菌培养阴性时,检测样本中的新型隐球菌荚膜抗原[74](强,高)。推荐在没有分子诊断资源的地区,采集足量组织样本以同时进行组织病理学和真菌涂片镜检、培养以诊断真菌感染[75](强,高)。对于COVID-19相关的肺毛霉病(COVID-19 associated pulmonary mucormycosis,CAPM),建议进行经胸穿刺活检,以诊断外周胸部病变患者的CAPM[76](弱,中)。 7.鼻窦样本:推荐采集感染部位2~3块的组织或抽吸物送检(强,低)。当真菌侵袭鼻窦部引起慢性鼻窦炎时,建议样本仅从鼻腔较大的一侧收集并在 24 h内送往真菌学实验室[77](弱,低)。
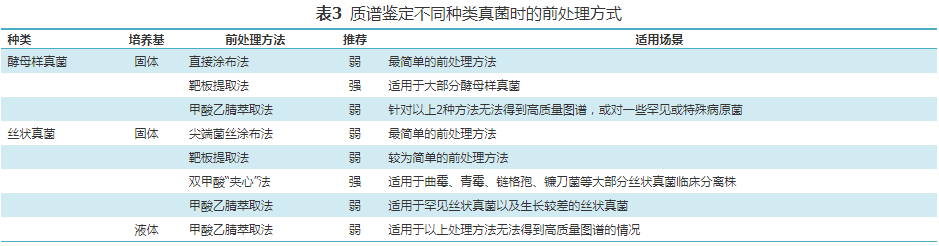
三、检验技术 1.样本涂片镜检:临床考虑侵袭性深部真菌感染采集的样本,均应进行直接涂片镜检(强,高)。直接涂片可评估样本质量,快速明确样本中是否存在真菌,尤其是对尚不能常规培养或常规生长极其缓慢的真菌,以及危重感染患者尤为重要。对于在组织样本中具有特征性形态(注意分隔、分支等)的真菌,直接涂片即可明确诊断。受制于样本中含菌量的多少和直接镜检敏感性等因素,检出真菌孢子或菌丝可明确表示样本中有真菌存在,但阴性并不能排除真菌感染。 直接涂片前应根据样本类型进行前处理以提高真菌检出阳性率(强,中)。脑脊液、胸腹腔积液、关节炎、BALF等液体性样本需浓缩离心后涂片;黏稠性痰液、脓液、胸腹腔积液等可采取酶液化后涂片;大体积的组织样本应多处取样,印片或剪碎组织压片;少量样本应床旁迅速压片以免干燥。 所有样本均推荐进行真菌免疫荧光染色,为提高真菌检出的阳性率和准确性,建议采用多种染色方法联合检查(强,高)。真菌免疫荧光染色几乎对所有的真菌均具有敏感度高、特异性强的特点;耶氏肺孢子菌感染的诊断宜用荧光染色与六胺银染色联合检测;隐球菌感染的诊断宜用荧光染色联合墨汁染色和革兰染色;毛霉目感染的诊断宜用荧光染色联合糖原染色。 直接镜检应仔细查找真菌孢子、菌丝和特殊结构[78, 79](强,中)。孢子可以从其形态、出芽与否及出芽方式,有无假菌丝、厚壁孢子、内生孢子、荚膜等特点来鉴别,菌丝可以从菌丝的大小、有无分隔、菌丝颜色等分辨。真菌特殊结构如颗粒、菌核、硬壳小体对于真菌诊断具有重要价值。推荐涂片镜检结果报告,应报告是否检出真菌,并详细描述镜检发现的真菌孢子形状、排列方式,以及菌丝的形态,仅报告真菌检出阳性或阴性是不够的(强,高)。酵母样、腊肠样孢子,内含孢子、厚荚膜圆形孢子等具有特征性的孢子;假菌丝,透明有隔菌丝,无隔飘带样毛霉目样菌丝,暗色菌丝等特征性菌丝——这些初步快速检测结果对于临床诊断方向具有重要参考价值。 2.培养:根据样本来源、可能的病原菌选择合适的培养基,建议实验室配备多种培养基,如不含细菌抑制剂(如氯霉素、放线菌酮等)和含细菌抑制剂的改良沙氏培养基、马铃薯葡萄糖琼脂、增菌培养基、念珠菌显色平板、真菌血培养瓶、常规细菌血培养瓶(弱,低)。进行正常无菌部位样本培养时,推荐同时使用不含细菌抑制剂的培养基和增菌培养基(强,低)。进行非无菌、非皮肤来源样本培养时,推荐同时使用含细菌抑制剂和不含细菌抑制剂的培养基、增菌培养基(强,低)。组织样本应剪碎后半埋在培养基中,不推荐用接种环进一步划线,怀疑组织胞浆菌感染时,推荐研磨组织;角膜分泌物推荐直接接种于培养基;无菌体液、BALF推荐离心取沉淀物接种(强,低)。 初始真菌培养推荐25~30 ℃孵育,保持足够的湿度,深部样本如活检组织、BALF、脑脊液等推荐35~37 ℃同时孵育;血培养瓶遵循说明书要求(强,低)。丝状真菌建议平板培养基孵育3周,怀疑双相真菌(如组织胞浆菌)感染建议延长至4~6周。血培养瓶培养2~4周(弱,低)。 3.传统鉴定方法和微生物质谱鉴定方法:传统鉴定方式对人员能力、检测体系和质量控制都有一定要求。实验室必须完成人员考核、能力验证,并常规进行质量控制(强,低)。对酵母型菌落和类酵母型菌落,推荐基于菌落形态、镜下形态、化学反应/同化反应、显色培养基(如CHROMagar念珠菌显色培养基)等方式,进行传统鉴定(强,中)。考虑念珠菌属以及其他酵母菌时,建议通过玉米-吐温琼脂上的菌落形态、厚壁孢子的产生与否、尿素酶试验、在含细菌抑制剂培养基上的生长能力、沙氏肉汤中的生长模式、对糖类的发酵同化作用等生长特性进行鉴定(弱,中)。 对丝状型菌落和双相真菌,建议以马铃薯葡萄糖培养基上的菌落形态、生长速度、产生的色素,镜检特征性孢子和菌丝为主要依据,初步判断丝状真菌的种属(弱,中)。镜检建议通过乳酸酚棉蓝染色或小培养法显微镜镜下观察菌丝分隔情况、颜色、形态、附着结构、产孢结构等(弱,低)。对于菌丝不分隔或很少分隔者,可根据菌落形态、产孢结构、假根等特征将其分为毛霉目(根霉属、毛霉属、根毛霉属、横梗霉属、共头霉属、小克银汉霉属)、虫霉目(耳霉属)、蛙粪霉目(蛙粪霉属)。对于菌丝分隔者,若菌丝为暗色,则需在离蠕孢属、枝孢霉属、德氏霉、链格孢霉属、外瓶霉属、瓶霉属、弯孢霉属间鉴别;若为透明菌丝,怀疑为丝状真菌,可根据顶囊、假头、孢子(产生方式、形态和排列状态)等特征进行曲霉属、镰刀霉属、枝顶孢霉属、拟青霉属、赛多孢属、木霉属、帚霉属间鉴别;怀疑为癣菌,则进行小孢子菌属、毛癣菌属、表皮癣菌属内鉴别;怀疑为双相真菌,则进行组织胞浆菌、粗球孢子菌属、皮炎芽生菌、副球孢子菌属、申克孢子丝菌、马尔尼菲篮状菌的鉴别。 对基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)技术,必须明确鉴定范围(参见说明书),并定期完成质控。能力具备时考虑自建库,须进行能力验证(强,中)。不同真菌的前处理方式见表3。推荐对酵母样真菌进行MALDI-TOF MS技术鉴定。推荐靶板提取法(强,中)。靶板提取法未产生可接受的鉴定结果或出于生物安全考虑时,建议使用甲酸乙腈萃取法处理酵母样真菌(弱,低)。一般培养18~24 h的酵母样真菌适宜用于质谱鉴定,而生长较慢的酵母样真菌可延长至48 h。美国临床和实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI)指南CLSI-M58推荐1×105~1×107 CFU/孔位的菌量以提高鉴定性能。明确质谱数据库中酵母样真菌鉴定范围,并进行定期更新。对丝状真菌,建议采用:(1)制造商推荐的甲酸乙腈萃取法(弱,低);(2)双甲酸“夹心”法作为前处理方法[80](强,中)。不建议对原始样本直接进行MALDI-TOF MS检测。对血培养、体液增菌培养样本中酵母菌,可以尝试该技术,但须进行性能验证(弱,低)。
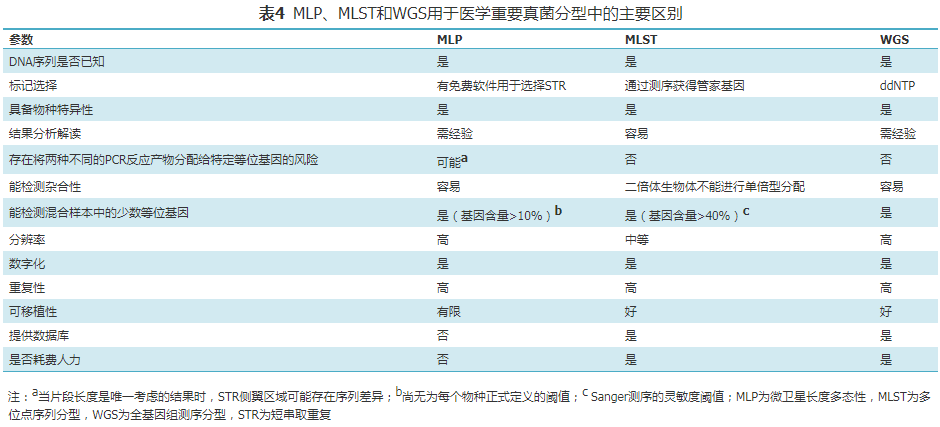
4.免疫学检测:脑脊液和血液样本中,隐球菌荚膜多糖抗原检测阳性为隐球菌脑膜炎的确诊指标;血液样本隐球菌抗原检测阳性作为肺隐球菌病的确诊证据之一;对于检测阳性者,推荐进行半定量检测[59,62](强,高)。动态监测荚膜多糖抗原滴度,结合临床因素可作为启动治疗和调整治疗方案的证据[81, 82, 83]。 血清G实验阳性主要用于疑似IFD(包括念珠菌病、曲霉病、肺孢子菌病等)的辅助诊断,但不适用于隐球菌病和毛霉病;G实验NPV较高[84]。动态连续监测可用于指导念珠菌感染的抗真菌治疗[85](弱,中)。对G实验,输注白蛋白或球蛋白、血液透析患者、输注抗肿瘤的多糖类药物、使用磺胺类药物、外科手术后及样本接触某些纱布等可能造成假阳性;采血管污染可能出现假阳性;严重溶血样本可能造成假阳性[86]。近平滑念珠菌病时有一定假阴性率;抗真菌药物的使用可能造成假阴性。 推荐血液、BALF和脑脊液的曲霉GM试验阳性用于疑似IA(尤其是血液恶性疾病、化疗以及接受造血干细胞移植患者)的极似诊断[87]。在非粒细胞缺乏患者肺侵袭性曲霉感染时,BALF的GM试验敏感性高于血清[4,59](强,高)。建议动态监测,注意不同样本的判断阈值不同[4](弱,中)。阈值:单次血清或血浆GM值≥1.0、或BALF的GM值≥1.0、或单次血清或血浆GM值≥0.7并且BALF的GM值≥0.8、脑脊液GM值≥1.0可作为IA的阳性诊断标准。假阳性可见于其他真菌(马尔尼菲篮状菌、隐球菌等)感染、应用β内酰胺类抗菌药物(尤其是哌拉西林/他唑巴坦)、静脉注射含有半乳甘露聚糖成分的药物、食用曲霉污染的谷类及牛奶等[59,88]。假阴性可见于应用抗真菌药物、病情较轻、抗原浓度低等情况[59]。 曲霉特异IgG抗体是检测慢性空洞性肺曲霉病最敏感的方法,推荐曲霉特异IgE水平和血清总IgE升高用来确定诊断变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)[89, 90, 91](强,中)。曲霉特异IgG抗体检测可用于慢性肺曲霉病的诊断和治疗监测,推荐在治疗周期内至少检测3次[92]。念珠菌甘露聚糖抗原与甘露聚糖抗体联合检测适用于念珠菌菌血症和慢性播散性念珠菌病(弱,低)。 5.核酸PCR检测:PCR检测技术可在较短的时间内检测真菌DNA,有利于IFD的早期诊断。但到目前为止,具有注册证的PCR法诊断真菌感染的试剂盒有限。自建的PCR检测技术不能替代常规微生物学检测技术和病理学检查。推荐对真菌PCR检测的试剂、耗材进行性能验证,对结果进行全过程质量控制[93](强,高)。对于临床样本含有低丰度的真菌DNA或涂片可见真菌成分,但培养阴性时,建议采用已验证过的PCR方法对临床样本进行检测[59](弱,低)。 对于念珠菌血流感染,建议对全血液样本进行念珠菌通用PCR检测。该检测项目可用于念珠菌菌血症的排除诊断[4](弱,低)。对于耶氏肺孢子菌肺炎,建议对呼吸道样本进行PCR检测[4](弱,低)。国内有研究采用PCR对怀疑IFD的537例患者的痰样本进行检测,该方法对耶氏肺孢子菌检出的敏感度为99.28%,特异度为98.50%,阳性预测值为95.80%和NPV为99.75%,临床应用前景良好[94]。对于肺曲霉感染,建议对血液样本(全血、血清、血浆)、BALF进行曲霉通用PCR检测(弱,低)。2019年修订的EORTC/MSGERC指南中,全血、血清、血浆曲霉通用PCR法已纳入到IA极似诊断的真菌学标准[4]。欧洲临床微生物学和感染病学会(European Society for Clinical Microbiology and Infectious Diseases,ECSMID)、欧洲医学真菌学联合会(European Confederation of Medical Mycology,ECMM)和欧洲呼吸学会(European Respiratory Society,ERS)联合指南推荐适度使用BALF样本诊断IA[68]。其他下呼吸道样本可供参考。对于肺毛霉感染,建议对BALF、血清进行PCR检测(弱,低)。对于组织毛霉感染,建议对新鲜组织或福尔马林固定和石蜡包埋组织样本进行PCR检测。目前国内已经有针对组织样本中毛霉目真菌的分子检测方法,但由于缺乏标准化和全面临床评估,可作为组织病理和培养的辅助诊断方法[95]。 6. mNGS:mNGS在IFD病原学诊断中的临床应用范围包括免疫功能低下或重症IFD、疑难IFD、经验治疗和早期靶向治疗无效的IFD、对侵入性手术不耐受的IFD[96](强,中)。mNGS应用于IFD的报告解读,除了关注检测出病原真菌的特异性序列数和基因组覆盖度图之外,一定要结合临床表现、影像学、患者因素、微生物学其他检测结果、病理学检测结果、其他间接性感染性指标等综合判断[97](强,低)。 鉴于毛霉目真菌培养阳性率低、血清学G和GM试验不能覆盖等,对于免疫受损患者(如造血干细胞移植)高度怀疑毛霉目真菌感染时,推荐送检真菌涂片和培养的同时,进行血液或感染部位组织样本的mNGS检测(强,低)。耶氏肺孢子菌可在呼吸道定植,判读其mNGS结果时,推荐结合临床表现、影像学、患者因素、G实验、LDH等综合判断(强,低)。鉴于荚膜组织胞浆菌、马尔尼菲篮状菌和利什曼原虫在组织病理中难以区分,在非流行区组织病理怀疑以上病原体时,mNGS检测可作为辅助病原学诊断手段之一(弱,低)。在BALF中,mNGS测出少量新型隐球菌序列,应参考外周血或BALF隐球菌荚膜多糖抗原检测结果(强,低)。在BALF中,mNGS测出少量曲霉序列,应参考BALF GM实验结果(弱,低)。mNGS在 IFD 病原学诊断中的技术问题包括:高成本、人类患者宿主细胞的影响、外源微生物污染、厚壁真菌核酸提取效率低(尤其是隐球菌)等。mNGS应用于IFD病原学诊断的流程亟须标准化。 7.抗真菌药物敏感性试验:推荐使用肉汤稀释法进行抗丝状真菌药敏试验。微量肉汤稀释法和宏量肉汤稀释法检测抗丝状真菌MIC具有良好一致性。纸片扩散法可补充肉汤稀释法用于抗丝状真菌药敏试验[98](强,中)。推荐纸片扩散法培养基为不补充钙、镁的MH琼脂平板,接种浓度为0.4×106~5×106 CFU/ml。两性霉素B的判读标准为生长完全抑制的抑菌环,泊沙康唑、伏立康唑、伊曲康唑和卡泊芬净判读标准为80%抑制。进行肉汤稀释法抗丝状真菌药敏试验,方法、流程、质量控制及结果判读推荐参考CLSI M38[99],结果解释推荐参考CLSI M38M51S[100]及M57S[101](强,中)。推荐用RPMI-1640肉汤制备终浓度为0.4×104CFU/ml~5×104 CFU/ml的菌悬液。两性霉素B、伊曲康唑、泊沙康唑、伏立康唑、艾沙康唑的生长终点判断标准为100%抑制,氟康唑、氟胞嘧啶和酮康唑的生长终点判断标准为约50%抑制,棘白菌素类应用最低有效浓度(minimum effective concentration,MEC)生长终点的概念。目前只建立了伏立康唑对烟曲霉的临床折点。对于烟曲霉外的曲霉,两性霉素B、卡泊芬净、艾沙康唑、伊曲康唑、泊沙康唑和伏立康唑已建立了流行病学界值。 推荐使用肉汤稀释法进行抗酵母及酵母样真菌药敏试验。微量肉汤稀释法和宏量肉汤稀释法检测抗酵母及酵母样真菌MIC具有良好一致性。纸片扩散法可替代肉汤稀释法用于抗酵母及酵母样真菌药敏试验[102](强,中)。推荐纸片扩散法培养基为0.5%亚甲蓝+2%葡萄糖MH琼脂平板,接种浓度为0.5麦氏单位。两性霉素B的判读标准为生长完全抑制的抑菌环。唑类、氟胞嘧啶和卡泊芬净判读标准为量取至有正常大小菌落生长的抑菌环直径大小。进行肉汤稀释法抗酵母及酵母样真菌药敏试验,方法、流程、质量控制及结果判读推荐参考CLSI M27[103],结果解释推荐参考CLSI M27M44S[104]及M57S[101](强,中)。推荐用RPMI-1640肉汤制备终浓度为5×102~2.5×103 CFU/ml的菌悬液。两性霉素B的生长终点判断标准为100%抑制,唑类、氟胞嘧啶、棘白菌素类的生长终点判断标准为约50%抑制。目前只建立了白念珠菌、光滑念珠菌、克柔念珠菌、近平滑念珠菌、热带念珠菌、季也蒙念珠菌的药敏试验判定折点。 结果报告应关注特定菌种的天然耐药性和感染部位抗真菌药物的有效药物浓度(强,低)。药敏试验报告中,不报告对特定药物具有天然耐药性的实验结果,如隐球菌属不报告棘白菌素类;克柔念珠菌不报告氟康唑;红酵母菌属不报告棘白菌素类及氟康唑;曲霉属不报告氟康唑;淡紫紫孢菌不报告两性霉素B;毛霉目不报告氟康唑、伏立康唑、伊曲康唑和棘白菌素类;毛孢子菌属不报告棘白菌素类;镰刀菌属不报告氟康唑和棘白菌素类;多育节荚孢霉不报告两性霉素B及氟康唑。泌尿系统感染不报告棘白菌素类、伏立康唑、伊曲康唑,眼部感染不报告棘白菌素类。 结果解释需注意临床折点和流行病学界值的不同意义(强,低)。临床折点的建立是基于MIC分布、药物代谢动力学/药效学参数、临床疗效与MIC结果的关系,可预测临床疗效,可将菌株分为敏感、剂量依赖性敏感、中介、耐药或非敏感。流行病学界值仅根据体外数据建立,基于MIC分布,不能预测临床疗效,但可识别耐药突变菌株,可将菌株分为野生型与非野生型(有/无获得性耐药或敏感性降低)。 8.真菌同源性分析:医学上重要真菌基因分型在研究真菌感染的暴发、医院传播、感染途径和基因型表型相关性等方面都有应用,特别是在继发性耐药方面有较深入的研究。目前比较常用的方法有3种:多位点序列分型(multilocus sequence typing,MLST)、使用短串联重复(short tandem repeat,STR)标记的微卫星长度多态性(microsatellite length polymorphism,MLP)和全基因组测序分型(whole-genome sequencing,WGS)[105, 106, 107, 108]。 建议采用MLST、MLP 和 WGS 技术,对目标菌株进行同源性判断。依据技术特点(表4)和实验室实际能力,选择相应技术。MLST和MLP不能确定分型的菌株可使用WGS进行分型(弱,低)。IC通常使用MLP或MLST基因分型方法。在耳念珠菌病,MLP分型具有快速、高分辨率的特点,有助于在亚种水平上对临床分离株进行初步分类 [109, 110](弱,低)。曲霉流行病学研究推荐使用MLP方法[105](弱,低)。
四、会诊 IFD的会诊,推荐医务部门安排感染病学、临床微生物学、临床药学、影像医学、病理学和相关基础疾病的专科一起参与形成多学科团队会诊(强,高)。临床微生物学参与会诊,不必拘泥于是否有执业医师执照。具备一定的临床和微生物学经验,能够结合会诊患者的实际给出具体解释和建议,即可参与会诊(弱,低)。IFD的确诊和极似诊断都需要相应层面的微生物学证据。非无菌样本如果培养阳性或其他检查结果阳性,但不具备临床表现和影像学特征,考虑为定植(弱,低)。 1.侵袭性念珠菌病:血液、其他深部组织样本和无菌体液(24 h内的手术部位样本和/或引流液)微生物学涂片检查和/或组织病理学检查发现念珠菌可以确诊(强,高)。非培养方法(G实验、念珠菌抗原和抗体检测、PCR检测等)可作为极似诊断的微生物学证据,结合患者临床严重程度、风险因素可形成极似诊断[111, 112](强,中)。非无菌部位的样本发现念珠菌通常是定植状态,不能单独用于相应样本部位的侵袭性感染的确诊或极似诊断,但是如果有多部位定植(指同时在2个或2个以上部位分离出念珠菌,即使菌种不同)或某一部位持续定植(指每周至少2次非连续培养阳性)可作为IC的风险因素(弱,低)。对COVID-19患者早期评估CAC,念珠菌评分可能没有意义(弱,低)。会诊最佳策略是通过评估临床风险因素和定植状态,结合非培养方法结果,考虑IC极似诊断的可能性,及早启动抗真菌治疗。经验性治疗首选棘白菌素(强,高)。非重症无氟康唑暴露患者也可选择氟康唑治疗(强,高)。经验性抗真菌治疗4~5 d症状无改善,在启动经验性治疗后没有发现侵袭性念珠菌感染证据,或非培养方法阴性且具有较高的NPV,建议停止抗真菌治疗(强,低)。推荐每天或隔天进行随访血培养,确认念珠菌是否清除,从而评估抗真菌治疗的疗程,在确认培养阴性、病原菌清除后再继续用药14 d(强,中)。建议对所有培养到的耳念珠菌进行药敏试验,包括定植。耳念珠菌对三唑类及两性霉素B耐药率高,推荐经验性治疗首选棘白菌素类;对中枢神经系统或者尿路感染,推荐两性霉素B,或者同时联合氟胞嘧啶(弱,低)。IC的预防用药推荐氟康唑(强,高)。明确念珠菌菌血症诊断后,会诊时应指导迁徙部位的评估,重点包括眼底检查以排除眼内炎,完善肝脏、肾脏CT以排除感染,腰椎穿刺脑脊液进行培养等检查以排除中枢神经系统感染(强,高)。目标性治疗无效,往往没有充分评估感染迁徙部位,感染灶没有彻底清除,选择的抗真菌药物在感染灶分布浓度低,比如中枢和肾脏感染,棘白菌素类不能到达,需要联合其他种类的敏感抗真菌药物,或需要外科干预去除感染灶。 2.隐球菌病:血液、其他深部组织样本和无菌体液(脑脊液等)涂片墨汁染色阳性、培养阳性和/或组织病理发现隐球菌可以确诊。脑脊液、血液的隐球菌荚膜抗原检测阳性也可作为隐球菌病的确诊证据(强,高)。痰液、BALF等隐球菌可定植部位样本培养出隐球菌不可作为确诊指标,但可作为肺隐球菌病极似诊断的微生物学证据。非培养方法PCR等分子诊断方法也可作为极似诊断的微生物学证据(强,高)。非侵袭性隐球菌病首选氟康唑治疗,重症播散性感染推荐应用两性霉素B脂质体联合5-氟胞嘧啶强化治疗,巩固期选用氟康唑治疗[113](强,高)。伏立康唑和泊沙康唑用于补救治疗,而棘白菌素类(阿尼芬净、卡泊芬净和米卡芬净)对隐球菌没有体内活性。持续感染及复发者,推荐测定最初分离菌株和复发菌株的MIC。如果MIC较前升高3个稀释度或更多,需考虑可能已经产生耐药。另外,如果菌株对氟康唑的MIC≥16 mg/L或氟胞嘧啶≥32 mg/L,要考虑耐药,更换药物。已经使用过唑类药物者,单独增加唑类药物剂量通常无效,不予推荐。脑脊液的培养、墨汁染色以及血清抗原滴度的连续监测不是治疗反应的可靠指标,疗效需要临床综合评估。 3.曲霉病:无菌样本真菌涂片和培养发现曲霉,或组织病理发现曲霉是确诊标准(强,高)。COVID-19相关曲霉病:尚无诊断的金标准,建议参考ECMM和国际人与动物真菌学会共识定义[114](弱,低)。呼吸道样本(痰液、气道吸出物和BALF)培养出曲霉往往很难除外污染和气道定植,但是直接镜检发现曲霉菌丝临床意义大,可以指导临床开始经验性抗真菌治疗(强,中)。如果培养阳性,需要结合涂片结果,单独培养阳性需要结合患者的风险因素和影像学特征作出肺曲霉病的极似诊断(强,中)。非培养方法包括GM试验(血液、BALF和脑脊液)和PCR检测可以作为极似诊断的微生物学证据(强,中)。肺曲霉病患者优选BALF的GM试验,该试验可以帮助区分培养阳性是定植还是感染(强,高)。对于正在进行曲霉病预防治疗的患者,诊断突破性侵袭性感染,血清GM试验敏感性低,容易导致假阴性,但是BALF的GM试验有临床意义,可以单独或联合PCR检测协助诊断新的突破性感染(强,低)。推荐伏立康唑作为治疗IA的一线治疗药物,推荐监测药物浓度(强,高)。其他新型三唑类抗真菌药,如艾沙康唑也可作为一线治疗药物,特别是在严重和长期免疫抑制,不能除外合并其他真菌时(强,高)。推荐泊沙康唑作为挽救性治疗(强,中)。脂质体两性霉素B可作为三唑类不耐受者的替代治疗(弱,中)。棘白菌素类可考虑作为伏立康唑、艾沙康唑之后的二线治疗或挽救性治疗(弱,中)。GM试验的结果变化可用于临床疗效评估(弱,中)。三唑类预防治疗发生突破性感染时,推荐应用脂质体两性霉素B(强,高)。如果脂质体两性霉素B治疗时出现突破性感染,推荐改用伏立康唑或艾沙康唑(强,高)。曲霉特异性IgG水平升高可以是慢性曲霉病极似诊断的微生物学证据,曲霉特异性IgE水平升高可以作为变应性支气管肺曲霉病诊断的微生物证据[75,115](强,高)。 4.肺孢子菌肺炎:通过组织、BALF、痰液以及诱导痰的常规六胺银染色镜检,发现肺孢子菌特征性微观结构如包囊或滋养体可作为PCP的确诊证据(强,高)。核酸检测(PCR、mNGS等)方法阳性,需要除外定植状态,结合患者风险因素和影像学特征可以作为极似诊断的微生物学证据,从而开始早期的治疗(弱,中)。G 试验也可作为极似诊断的微生物学证据,但其升高程度与病情严重程度无相关性(强,中)。美国移植学会强调G实验及LDH同时阴性对PJP有较高的NPV。推荐免疫抑制患者应以预防为主,尤其是有定植的患者。复方磺胺甲噁唑是目前临床预防和治疗PJP的首选药物[116](强,高)。有磺胺类过敏史的患者因病情所需却无更好的替代药品治疗时,可以尝试脱敏治疗。因肾脏功能受损,限制了磺胺药物的足量应用而影响疗效,可以联合卡泊芬净以达到较好的治疗效果(弱,低)。 5.毛霉病:从感染部位获得的无菌样本(手术、内镜或CT引导下穿刺组织)涂片镜检、培养或组织病理发现典型的特征可以确诊(强,高)。COVID-19确诊后,建议关注CAM。鼻眶脑毛霉病患者的鼻腔样本、肺毛霉病的BALF、痰液样本,若涂片和培养发现典型的毛霉特征可以为极似诊断提供微生物学证据(强,高)。核酸检测(PCR、mNGS等)方法也可以提供极似诊断的微生物学证据(弱,低)。GM和G实验可用于其他真菌的鉴别诊断或混合感染(弱,中)。对确诊或极似诊断毛霉病的患者,推荐紧急启动临床处置,使用两性霉素B脂质体进行一线抗真菌治疗,备选方案为艾沙康唑或泊沙康唑(强,高)。除了系统性抗真菌治疗外,推荐尽早进行外科手术治疗[44](强,高)。推荐严格控制血糖,并优化糖皮质激素的使用(强,低)。 6.其他深部真菌病:包括马尔尼菲篮状菌、镰刀菌、赛多孢以及地方性真菌病等。确诊标准是血液、其他深部组织样本和无菌体液涂片、培养阳性或组织病理发现典型的真菌结构(强,高)。mNGS检测可以作为极似诊断的微生物学证据(弱,低)。侵袭性感染的治疗:马尔尼菲篮状菌推荐两性霉素B诱导治疗+伊曲康唑巩固治疗的序贯疗法;镰刀菌推荐两性霉素B脂质体治疗,备选是伏立康唑、泊沙康唑;赛多孢推荐伏立康唑治疗,必要时考虑手术干预(强,高)。 说明:部分念珠菌菌种已经成为新的菌属成员。如克柔念珠菌改名为库德里阿兹威毕赤酵母;光滑念珠菌改名为光滑奈卡菌;季也蒙念珠菌改名为季也蒙麦尔酵母复合群。接合菌、假阿利什霉等名字不再使用,相应改为毛霉目、赛多孢。假丝酵母菌属统一为念珠菌属。本文按照日常工作惯例行文。具体菌名请查阅相关文献。
指南制定委员会名单 项目主持人:王辉(北京大学人民医院检验科) 执笔人(按姓名拼音顺序):陈宏斌、董亮、谷丽、顾兵、康梅、廖康、刘波、刘学东、刘智博、宁永忠、苏欣、陶传敏、王辉、王启、王一民、吴文娟、徐和平、许建成、杨国儒、杨青、余跃天、曾吉、张嵘、赵鸿、赵宗珉 专家组成员(按姓名拼音顺序):曹敬荣(首都医科大学宣武医院检验科),陈良(复旦大学附属上海市公共卫生临床中心肝病科),陈天艳(西安交通大学第一附属医院感染科),陈宏斌(北京大学人民医院检验科),戴媛媛(中国科学技术大学附属第一医院检验科),邓继岿(深圳市儿童医院感染科),董亮(山东第一医科大学第一附属医院、山东省呼吸疾病研究所),杜鸿(苏州大学附属第二医院医学检验中心),杜艳(昆明医科大学第一附属医院医学检验科),福泉(内蒙古医科大学附属医院检验科),高燕(北京大学人民医院感染科),谷丽(首都医科大学附属北京朝阳医院感染和临床微生物科),顾兵(广东省人民医院检验科),郭大文(哈尔滨医科大学附属第一医院检验科),韩立中(上海交通大学医学院附属瑞金医院临床微生物科),胡必杰(复旦大学附属中山医院感染科),胡继红(国家卫生健康委临床检验中心),胡志东(天津医科大学总医院医学检验科),贾伟(宁夏医科大学总医院医学实验中心),江建宁(广西医科大学第一附属医院感染科),金大智(杭州医学院检验医学院),康梅(四川大学华西医院实验医学科),李海英(宝鸡市人民医院检验科),李敏(上海交通大学医学院附属仁济医院检验科),李轶(河南省人民医院检验科),廖康(中山大学附属第一医院检验科),林锋(海南省人民医院感染科),刘波(淄博市市立医院,淄博市呼吸感染与临床微生物重点实验室),刘根焰(南京医科大学第一附属医院检验科),刘文恩(中南大学湘雅医院检验科),刘学东(青岛市市立医院呼吸与危重症医学科),刘智博(中日友好医院呼吸与危重症医学科),鲁炳怀(中日友好医院呼吸与危重症医学科临床微生物与感染实验室),罗春玉(赤峰学院附属医院检验科),罗燕萍(解放军总医院检验科),马晓波(厦门大学附属第一医院检验科),马筱玲(中国科学技术大学附属第一医院检验科),宁永忠(北京市垂杨柳医院检验科),任万华(山东第一医科大学附属省立医院感染科),单斌(昆明医科大学第一附属医院医学检验科),苏欣(南京大学医学院附属鼓楼医院呼吸与危重症医学科),孙宝霞(枣庄市立医院感染性疾病科),孙宏莉(中国医学科学院中国协和医科大学北京协和医院检验科),陶传敏(四川大学华西医院实验医学科),田国宝(中山大学中山医学院),王红梅(郑州大学第一附属医院检验科),王辉(北京大学人民医院检验科),王启(北京大学人民医院检验科),王一民(中日友好医院 武汉市金银潭医院呼吸与危重症医学科),魏莲花(甘肃省人民医院检验科),吴文娟(同济大学附属东方医院南院检验科),吴伟元(深圳市人民医院检验科),邢西迁(云南大学附属医院呼吸与危重症医学科),徐和平(厦门大学附属第一医院检验科),徐修礼(西安区域医学检验中心),许建成(吉林大学第一医院检验科),杨国儒(潍坊呼吸病医院,潍坊市第二人民医院,呼吸中心),杨青(浙江大学医学院附属第一医院检验科),姚立琼(兰州大学第一医院检验科),余方友(同济大学附属上海市肺科医院检验科),余跃天(上海交通大学医学院附属仁济医院重症医学科),俞云松(浙江大学医学院附属邵逸夫医院感染科),喻华(四川省医学科学院·四川省人民医院临床医学检验中心),曾吉(武汉市第四医院检验科),张静(复旦大学附属中山医院呼吸与危重症医学科),张嵘(浙江大学医学院附属第二医院检验科),张智洁(中国医科大学附属盛京医院检验科),赵彩彦(河北医科大学第三医院感染科),赵鸿(北京大学第一医院感染科),赵建宏(河北医科大学第二医院检验科,河北省临床检验中心),赵玲莉(青海大学附属医院检验科),赵宗珉(中国医科大学附属第一医院感染科),朱镭(山西省儿童医院临床医学检验中心科研部),宗志勇(四川大学华西医院感染性疾病中心)
参考文献(略)