
-
德国维润赛润CACLP展位号:B5-0805
准确度评估资料是评价拟上市产品有效性的重要依据,也是产品注册所需的重要申报资料之一。定量检测方法的方法学比对试验是评估准确度的方法之一,可以与参考方法或临床公认质量较好的已上市产品进行比对。
除此之外回收实验也是评估准确度的方法之一,用于评估定量检测方法准确测定待测分析物的能力,结果用回收率表示。
本篇针对上述两种方法的技术审查指导原则进行阐述
准确度-方法学比对
(一)方法学比对实验的基本要求
1.操作者应熟悉待评价系统和比对系统的操作。
2.编写系统标准操作规程,其中包括校准程序和室内质控程序,采用合适的校准品、质控品并保持仪器处于正常状态。
3.比对系统的选择
比对系统应具有以下条件:
(1)具有比待评价系统更好的精密度;
(2)同待评价系统检测结果具有相同的单位;
(3)如有参考方法应具有与参考方法已知的偏差。
比对系统应该选择正确性经过验证的系统,根据实际条件,选择的顺序如下:参考方法、原装系统、配套系统、经过验证的非配套系统。
4.待评价系统的处理
进行方法学对比实验前,应该对待评价系统进行初步评价,并且对待评价系统进行精密度及线性的评价(参考相关标准),只有在以上评价完成并且符合相关标准要求后,才可进行方法学对比实验。
(二)方法学比对实验的评估及数据处理方法
1.实验样本的基本要求
(1)按照实验对样本的要求收集处理病人样本,样本贮存时间及条件由被测组分的稳定性而定,尽可能避免使用贮存的样本。
(2)样本应来自于不同患者,并且此患者所患疾病对于被测组分的影响应该是已知的,样本不应含有干扰此方法的组分。
(3)样本浓度应在方法的线性范围内,并覆盖医学决定水平。通常基本从线性范围的低限到线性范围的高限(应至少有50%的样本在参考范围以外,但在线性范围内)。分析样本的浓度应尽可能在线性范围内均匀分布。商品质控物或者校准物可能存在基质效应,应避免使用。
2.实验过程
(1)每天选择8个临床患者样本,按1到8的顺序编号。用两种方法同时进行实验,按照1,2,3,4,5,6,7,8,8,7,6,5,4,3,2,1的样本顺序进行测定。
(2)以上实验至少重复5天,即至少分析40个不同的临床患者样本。每天实验必须进行校准和室内质控,只有在室内质控合格的情况下,当天的实验室数据才有效。
3.数据处理及结果报告
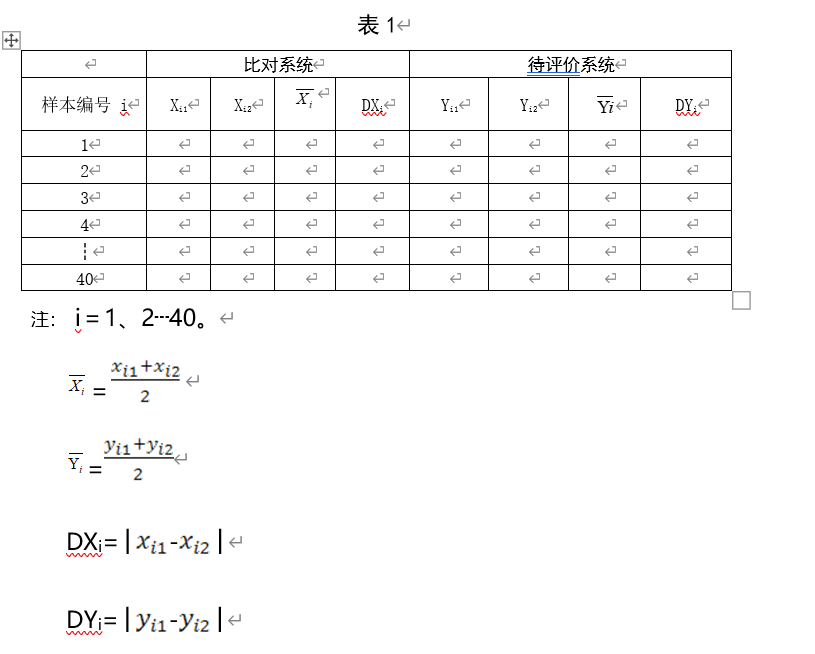
(1)记录测定结果(Xij和Yij),
Xij 为比对系统测定值
Yij为待评价系统测定值
i为测定样本的序号(1、2、3…40)
j为同一样本同一天测定的次序(1、2)
(2) 计算每个样本测定的均值(和),样本重复测定间差值的绝对值(DXi 和DYi)及两种方法测定结果间的均值差值(-)。相关实验记录见表1。
(3)以对作散点图。
(4)以(-)对做偏倚图。
(5)以(Yij-Xij)对做偏倚图。
(6)检查批内离群点:计算样本重复测定间差值(DXi 和DYi)的平均数,

样本重复测定间差值超出该平均数4倍时,则判断为离群点,如离群点超过1个时,整组数据应舍弃,寻找原因后重新进行评价。如离群点为1个,可以补充数据后重新进行统计。
(7)检查批间离群点:计算两种方法测定结果间均值差值(│-│)的平均数,如两种方法测定结果间均值差值超出该平均数4倍时,则判断该样本为离群点,如离群点超过1个时,整组数据应舍弃,寻找原因后重新进行评价。如离群点为1个,可以补充数据后重新进行统计。
(8)相关系数计算:利用所有样本双份测定值进行相关系数计算,如果≥0.975(或2≥0.95),则认为选择的数据范围适合,数据满足要求。该分析的误差可以由数据范围给以适当补偿,并且可以采用简单的线性回归来评价斜率和截距。
如果r2<0.95,那么必须通过分析另外一些样品以扩大数据范围,然后再检查全部数据系列,如仍然r2<0.95,则应寻找待评价方法存在的缺陷,纠正后重新进行试验。
对于某些免疫项目,可适当放宽标准,原则上r2≥0.90,则认为数据范围适合,数据满足要求。
(9)回归计算:利用所有样本双份测定的有效数据,计算两个方法间的线性回归方程:Y= bX+a。
(10)偏差估计:在医学决定水平,利用回归方程计算预期偏差,预期偏差Bx=a+(b-1)X,相对偏差=Bx/X。
(11)结果评估:结果至少应满足相关国际及国家标准,同时满足临床需求。
其他应注意的问题
(一)采用的患者样本对于被测组分的影响应该是已知的,样本不应含有干扰此检测方法的组分。
(二)样本贮存时间及条件由被测组分的稳定性而定,尽可能避免使用贮存的样本。
(三)实验前必须对待评价系统进行精密度及线性的评价,评价合格后方可进行实验。
名词解释
(一)待评价系统:拟进行性能评估的产品。
(二)比对系统:参考方法(系统)或临床公认质量较好的已上市产品。
参考文献:
EP9-A2: Method comparison and bias estimation using patient samples; Approved Guideline-Second Edition.
准确度-回收实验
(一)回收实验的基本要求
1.操作者应熟悉待评价系统的操作。
2.编写系统标准操作规程,其中包括校准程序和室内质控程序,采用合适的校准品、质控品并保持系统处于正常状态。
3.待评价系统的处理。进行回收实验前,应该对待评价系统进行初步评价,并且对待评价系统进行精密度及线性评价(参考相关标准),只有在以上评价完成并且符合相关标准要求后,才可进行回收实验。
(二)回收实验的评估及数据处理方法
1.实验样本的基本要求和制备方法
(1)选择合适浓度的常规检测样本,分为体积相同的3-4份。
(2)在其中2-3份样本中加入不同浓度相同体积的待测物标准液制备待回收分析样本,加入体积小于原体积的10%,制成2-3个不同加入浓度的待回收分析样本,计算加入的待测物的浓度。
(3)在另一份样本中加入同样体积的无待测物的溶剂,制成基础样本。
2.实验过程
用待评价系统对待回收分析样本和基础样本进行测定,通常对样本进行3次重复测定,计算均值,取其均值进行下述计算。
3.数据处理及结果报告
(1)加入浓度n=标准液浓度n×[标准液加入体积/(样本体积+标准液体积)]
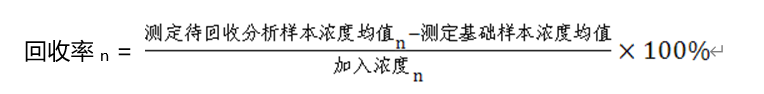
(2)计算回收率:
(3)计算平均回收率:
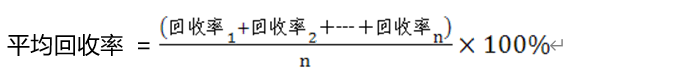
(4)计算每个样本回收率与平均回收率的差值:
每个样本回收率与平均回收率的差值=回收率n-平均回收率
如差值超过±10%,应查找原因并纠正,重新进行评估。
(5)计算比例系统误差:
比例系统误差 = |100% – 平均回收率|
(6)结果评估:
结果至少应满足相关国际及国家标准,同时满足临床需求。
4.范例——某法测定血清葡萄糖回收率
(1)样本制备:
①基础样本血清:血清1ml(葡萄糖浓度5.5mmol/L)+蒸馏水0.1ml;
基础样本浓度=5.5/(1+0.1)=5 mmol/L
②回收样本1:血清1ml+0.1ml葡萄糖水溶液(浓度22mmol/L);
③回收样本2:血清1ml+0.1ml葡萄糖水溶液(浓度55mmol/L)。
(2)计算加入浓度:
加入浓度1=22×[0.1/(0.1+1.0)]=2mmol/L
加入浓度2=55×[0.1/(0.1+1.0)]=5mmol/L
(3)采用待评价系统,按照从低到高的浓度顺序,每个样本测定3次,取平均值,填入表1。
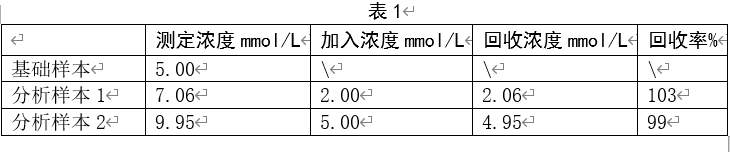
回收浓度1=7.06-5=2.06mmol/L
回收浓度2=9.95-5=4.95mmol/L
回收率1==103%
回收率2==99%
(4)计算平均回收率:
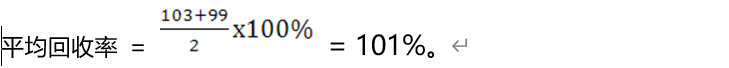
(5)计算每个样本回收率与平均回收率的差值:
分析样本1:103%-101%=2%
分析样本2:99%-101%=-2%
两个样本回收率与平均回收率的差值小于±10%,
(6)计算比例系统误差:
比例系统误差 = |100% – 101%| = 1%
(7)结果评估:1% (CLIA 88), 该方法的回收实验(准确度)可接受。
其他应注意的问题:
(一)加入体积:加入的待测物标准液体积一般在样本体积的10%以内,如果高浓度的待测物标准液不易得到, 加入体积亦不得超过原样本体积的20%。
加入的待测物标准液体积量不应影响样本基质;并且保证在加样过程中的取样准确度。
(二)加入的溶剂应不影响对待测物的测定。
(三)加入待测物标准液的浓度:保证总浓度在系统分析测量范围内,尽量使加入标准液后样本中的被测物浓度达到医学决定水平。
(四)待测物标准液浓度:因为待测物标准液溶液加入体积不到10%,为保证得到不同浓度的待回收分析样本,标准液的浓度应该足够高。
名词解释
(一)待评价系统:拟进行性能评估的产品。
(二)待测物标准液:待测物与相应的溶剂混合后制备的标准液。
(三)基础样本:样本与相应的溶剂混合制备成基础样本。
(四)待回收分析样本:样本与相应的待测物标准液混合制备成待回收分析样本。
参考文献
《临床实验室管理学》,申子瑜等,人民卫生出版社

公司简介
助力我们的客户更加强大
永葆我们的价值无可替代






