国家药监局综合司公开征求《医疗器械经营质量管理规范(修订草案征求意见稿)》意见(药监综械管函〔2023〕291号)
发布时间:2023-06-01
为贯彻落实《医疗器械监督管理条例》《医疗器械经营监督管理办法》,国家药监局组织起草了《医疗器械经营质量管理规范(修订草案征求意见稿)》,现向社会公开征求意见。
公开征求意见的时间是2023年5月30日—6月29日。有关单位和个人可以将意见反馈至qxjgec@nmpa.gov.cn,请在电子邮件主题注明“医疗器械经营质量管理规范—意见建议反馈”。
附件:1.医疗器械经营质量管理规范(修订草案征求意见稿)
2.意见建议反馈表模板
国家药监局综合司
2023年5月29日
附件下载:
附件1:医疗器械经营质量管理规范(修订草案征求意见稿).docx
关于公开征求《体外诊断试剂变更注册审查指导原则(征求意见稿)》意见的通知
发布时间:2023-05-31
各有关单位:
为规范技术审评要求,进一步指导注册申请人对申报资料的准备和撰写,我中心组织编制了《体外诊断试剂变更注册审查指导原则(征求意见稿)》(附件1),现向社会公开征求意见。
如有意见和建议,请填写意见反馈表(附件2),以电子邮件的形式于2023年6月30日前反馈至我中心相应联系人。邮件主题及文件名称请以“《体外诊断试剂变更注册审查指导原则(征求意见稿)》意见反馈+反馈单位名称”格式命名。
联系人:包雯、程曦
电话:010-86452596、010-86452580
电子邮箱:baowen@cmde.org.cn、chengxi@cmde.org.cn
附件:1.体外诊断试剂变更注册审查指导原则(征求意见稿)(下载)
2.意见反馈表(下载)
国家药品监督管理局
医疗器械技术审评中心
2023年5月30日
附件下载:
附件1:体外诊断试剂变更注册审查指导原则(征求意见稿).doc

公司简介

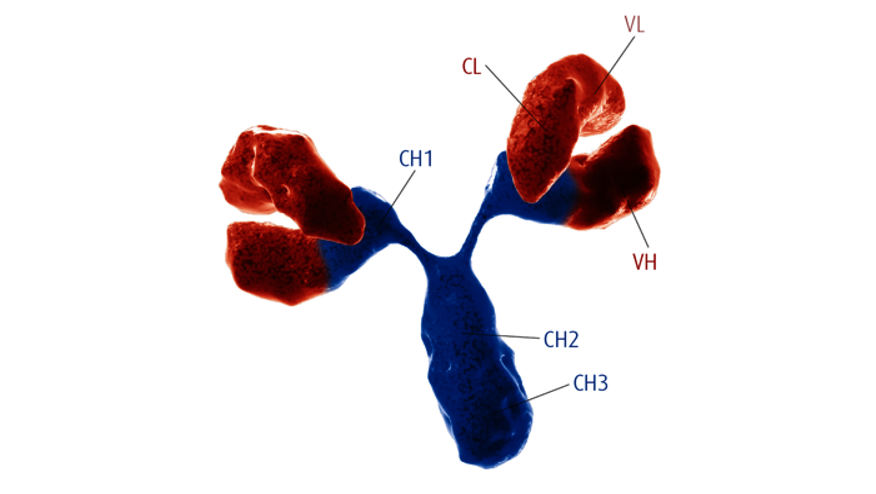
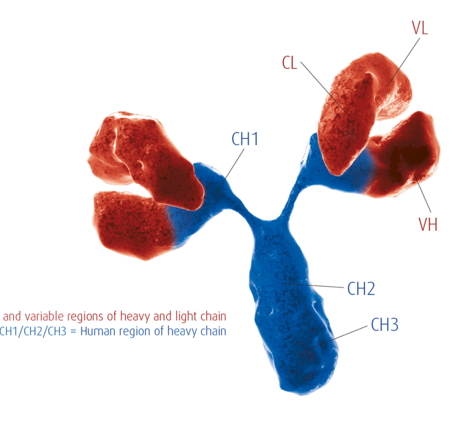
德国维润赛润(Institut VirionSerion GmbH)成立于1978年,是国际知名的诊断产业原料生产商和供应商。公司的研发和生产基地位于德国维尔茨堡,已通过DIN EN ISO 13485质量体系认证,拥有三级生物安全实验室(P3实验室)。经过了40余年的发展,公司构建了丰富的生物原料产品线,主要包括天然抗原、重组抗原、人源化单克隆抗体和磁珠等。
助力我们的客户更加强大
永葆我们的价值无可替代

免责声明:本文仅代表作者本人观点,不代表维润赛润资讯的观点和立场。文章图片均来源于网络,如有侵权,请联系作者删除,欢迎联系小编。